题目内容
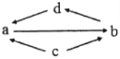
【题目】下表所列各组物质中,物质之间通过一步反应无法实现如图所示转化的是( )
物质转化关系 | a | b | c | d | |
A |
| FeCl2 | FeCl3 | Fe | CuCl2 |
B | SO2 | SO3 | S | H2SO4 | |
C | CH2ClCH2Cl | CH≡CH | CH2OHCH2OH | CH2=CH2 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A. AB. BC. CD. D
【答案】B
【解析】
利用各物质的性质及变化规律,根据题图所示的物质的转化关系,分析两种物质的转化能否通过一步反应实现,可使用举实例的方法帮助完成分析。
A.a→b→d→a,c→a c→b;FeCl2溶液和Cl2反应生成FeCl3,FeCl3溶液和Cu反应生成FeCl2和CuCl2,Fe和CuCl2溶液反应生成Cu和FeCl2,Fe和盐酸反应生成FeCl2和氢气,Fe在氯气中燃烧生成FeCl3;故A能实现;
B.a→b→d→a,c→a c→b;SO2和O2在催化剂加热条件下转化为SO3,SO3和水反应生成H2SO4,浓硫酸和铜加热反应得到SO2,硫燃烧生成SO2,但S不能直接转化为SO3;故B不能实现;
C.a→b→d→a,c→a c→b;CH2ClCH2Cl在氢氧化钠醇溶液加热条件下发生消去反应得到CH≡CH,乙炔和氢气加成可生成CH2=CH2,CH2=CH2和氯气加成生成CH2ClCH2Cl,CH2OHCH2OH和HCl发生取代反应生成CH2ClCH2Cl,CH2OHCH2OH在浓硫酸加热条件下发生消去反应得到CH≡CH;故C能实现;
D.a→b→d→a,c→a c→b;Al2O3和氢氧化钠溶液反应得到NaAlO2,向NaAlO2溶液通入CO2反应生成Al(OH)3沉淀,加热Al(OH)3分解生成Al2O3,铝和氧气反应生成Al2O3,铝和氢氧化钠溶液反应生成NaAlO2和氢气;故D能实现。
故选B。

【题目】实验室制备1,2-二溴乙烷的反应原理如下所示:
第一步:CH3CH2OH![]() CH2=CH2+H2O;
CH2=CH2+H2O;
第二步:乙烯与溴水反应得到1,2-二溴乙烷。
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃下脱水生成乙醚(CH3CH2OCH2CH3)。用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(部分装置未画出):

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g/cm3) | 0.79 | 2.2 | 0.71 |
沸点/(℃) | 78.5 | 132 | 34.6 |
熔点/(℃) | -130 | 9 | -116 |
请回答下列问题:
(1)写出乙烯与溴水反应的化学方程式:______。
(2)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_____(填字母代号)。
a.引发反应 b.加快反应速率
c.防止乙醇挥发 d.减少副产物乙醚生成
(3)装置B的作用是______。
(4)在装置C中应加入____ (填字母代号),其目的是吸收反应中可能生成的SO2、CO2气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在___ (填“上”或“下”)层。
(6)若产物中有少量副产物乙醚,可用____的方法除去。
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:

已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有___(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:___。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为___(填字母)。
a.加入过量的氨水
b.通入过量的CO2
c.加入过量的NaOH
d.加入适量的HCl
e.洗涤
f.过滤
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:___。
②若用浓HNO3溶解金属硫化物,缺点是___(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是___(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于___。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
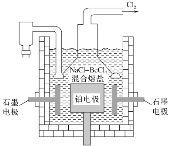
①石墨电极上的电极反应式为___。
②电解得到的Be蒸气中约含1%的Na蒸气,除去Be中少量Na的方法为___。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe42.35%、Cr9.67%、Ni5.1%、C4.7%、Si3.39%等)中制取硫酸镍晶体的工艺流程如图:
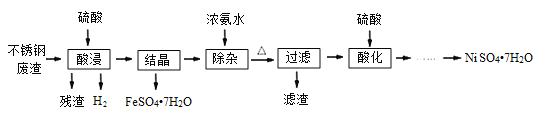 已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42-转化为Cr2O72-。
③相关物质在不同温度时溶解度如下表:
温度 溶解度/g 物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为___。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是___。
(2)“过滤”前,适当加热的目的是___。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是___。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为___。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,___,烘干得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
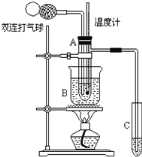
【题目】乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体),已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)_____________________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置:
①在实验开始时温度计水银球的位置应在_____________________;
②当试管A内的主要反应完成后温度计水银球的位置应在_______________,目的是________________________________________________;
(3)烧杯B内盛装的液体可以是________(写出一种即可);在实验的不同阶段,烧杯B的作用分别是_________________、______________________;
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案。所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方案为________________________________________。