题目内容
6.在一定温度下,容积不变的密闭容器里,能说明A(g)+3B(g)?2C(g)达到平衡状态的标志是( )| A. | 单位时间生成nmol A的同时生成3n mol | |
| B. | B.容器内压强不随时间的变化而变化 | |
| C. | A,B,C的浓度相等的状态 | |
| D. | A,B,C的分子个数比为1:3:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、单位时间生成nmol A的同时生成3n molB,只要反应发生就符合这个关系,故A错误;
B、随着反应的进行体系压强逐渐减小,容器内压强保持不变说明达平衡状态,故B正确;
C、当体系达平衡状态时,A,B,C的浓度可能相等,也可能不等,与各物质的初始浓度及转化率有关,故C错误;
D、当体系达平衡状态时,A,B,C的分子个数之比可能为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
16.下列各装置能构成原电池的是( )
| A. | 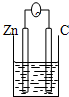 稀硫酸 | B. | 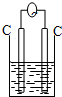 AgNO3(aq) | C. | 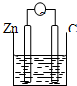 蔗糖 | D. | 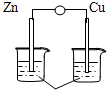 稀硫酸 |
17.下列叙述正确的是( )
| A. | 离子键只有饱和性没有方向性 | B. | 离子晶体中只含有离子键 | ||
| C. | 离子键的强弱可用晶格能来衡量 | D. | 离子键的强弱可用原子化热来衡量 |
14.有关能量的判断或表示方法正确的是( )
| A. | 由H+(aq)+OH-(aq)═H2O△H=-57.3 kJ/mol可知:含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| B. | 从C(石墨)═C(金刚石)△H=+1.19 kJ/mol可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| D. | 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol-1 |
1.下列说法不正确的是( )
| A. | 在电解池中阴离子向阳极移动;在原电池中阴离子向正极移动 | |
| B. | 在电解池中,阳极发生氧化反应,在原电池中,负极发生氧化反应 | |
| C. | 电解池的阳极与电源的正极相连 | |
| D. | 电解过程中,电子从电源的负极流出到达阴极,从阳极流出回到电源的正极 |
11.存放食品和药品的包装盒中常可发现一些袋装透明胶状颗粒,该颗粒材料可能的名称及其作用是( )
| A. | 活性炭、吸附剂 | B. | KMnO4、氧化剂 | C. | 氯化钠、干燥剂 | D. | 硅胶、干燥剂 |
18.下列各溶液中分别加入Na2O2后,既有无色气体又有白色沉淀产生的是( )
| A. | (NH4)2SO4溶液 | B. | MgCl2溶液 | C. | NaHCO3溶液 | D. | CuSO4溶液 |
15.下列有关说法正确的是( )
| A. | 饱和氯水中Cl-、NO3-、Na+、SO32-可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-+4H+ |
16.下列化学反应的离子方程式正确的是( )
| A. | 在稀氨水中通入过量CO2:NH3•H2O+CO2═NH4++HCO3- | |
| B. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| C. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | 等体积、等物质的量浓度的氢氧化钙溶液与稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |