题目内容
15.下列有关说法正确的是( )| A. | 饱和氯水中Cl-、NO3-、Na+、SO32-可以大量存在 | |
| B. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| C. | 向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色,说明原溶液中有I- | |
| D. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32-+2I-+4H+ |
分析 A.饱和氯水具有强氧化性,能够氧化亚硫酸根离子;
B.氯气与铁加热反应生成氯化铁;
C.紫色的为碘单质,说明是碘离子被氧化成后生成的;
D.反应生成硫酸根离子,不是亚硫酸根离子.
解答 解:A.SO32-与氯水发生氧化还原反应,不能大量共存,故A错误;
B.铁与氯气能够发生反应:3Cl2+2Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故B错误;
C.向无色溶液中滴加氯水和CCl4,振荡,静置,下层溶液显紫色,说明有碘单质生成,故原溶液中有I-,故C正确;
D.SO2通入碘水中,反应生成硫酸和碘化氢,正确的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+,故D错误;
故选C.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
5.下列关于工业生产的叙述中,错误的是( )
| A. | 制普通玻璃的主要原料是纯碱、石灰石、石英 | |
| B. | 氨是制作氮肥、硝酸、铵盐的重要原料 | |
| C. | 将氢气和氯气混合光照生成氯化氢,溶于水制得盐酸 | |
| D. | 制造普通水泥的主要原料是黏土、石灰石 |
6.在一定温度下,容积不变的密闭容器里,能说明A(g)+3B(g)?2C(g)达到平衡状态的标志是( )
| A. | 单位时间生成nmol A的同时生成3n mol | |
| B. | B.容器内压强不随时间的变化而变化 | |
| C. | A,B,C的浓度相等的状态 | |
| D. | A,B,C的分子个数比为1:3:2 |
10.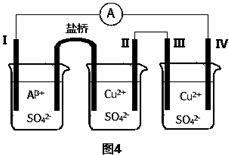 某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
 某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )| A. | 电流方向:电极Ⅳ→A→电极Ⅰ | B. | 电极Ⅰ发生还原反应 | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
20.高纯晶体硅是信息技术的关键材料.
(1)硅元素位于周期表的位置第三周期第ⅣA族.下面有关硅材料的说法中正确的是BCD(填字母).
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料---光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
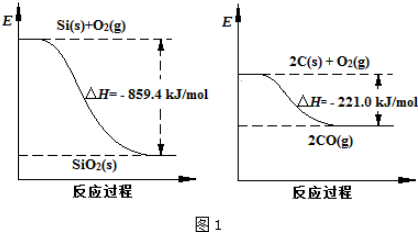
(2)工业上用石英砂和焦炭可制得粗硅.已知:图1
请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷.
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用蒸馏(或分馏) 方法提纯SiHCl3.
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g) $\stackrel{一定条件下}{?}$Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示.下列说法正确的是ac(填字母序号).
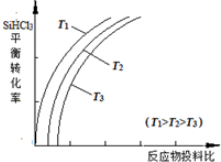
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是$\frac{n(SiHC{l}_{3})}{n({H}_{2})}$
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑.

(1)硅元素位于周期表的位置第三周期第ⅣA族.下面有关硅材料的说法中正确的是BCD(填字母).
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料---光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅.已知:图1
请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+638.4 kJ•mol-1
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:C和Si最外层电子数相同,C原子半径小于Si,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷.
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅.
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用蒸馏(或分馏) 方法提纯SiHCl3.
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |

a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是$\frac{n(SiHC{l}_{3})}{n({H}_{2})}$
c.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑.
7.乙烯与乙炔的混合气体100mL,加入300mL的O2,使之燃烧,生成的CO2在原条件下的体积(均为同温同压)是( )
| A. | 小于100 mL | B. | 200 mL | C. | 400 mL | D. | 无法确定 |
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的沸点:Y>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
5.工业上从含硒的废液中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸(2HCl+H2SeO4=H2SeO3+Cl2↑+H2O),在亚硒酸溶液中通入SO2,有单质硒析出.下列说法错误的是( )
| A. | 氧化性:H2SeO4>Cl2;H2SeO3>H2SO4 | |
| B. | 酸性:H2SO4>H2SeO4>H2SeO3 | |
| C. | 析出l mol硒需要消耗标准状况下22.4 L SO2 | |
| D. | 亚硒酸理论上既有氧化性,又有还原性,但还原性不及亚硫酸 |