题目内容
1.下列说法不正确的是( )| A. | 在电解池中阴离子向阳极移动;在原电池中阴离子向正极移动 | |
| B. | 在电解池中,阳极发生氧化反应,在原电池中,负极发生氧化反应 | |
| C. | 电解池的阳极与电源的正极相连 | |
| D. | 电解过程中,电子从电源的负极流出到达阴极,从阳极流出回到电源的正极 |
分析 A、电解池中阴离子向阳极移动;在原电池中阴离子向负极移动;
B、电解池中阳极、原电池的负极发生氧化反应,原电池的正极、电解池中阴极发生还原反应;
C、电解池中连接电源正极的为阳极,阴极连接电源负极;
D、原电池中电子由负极流出,正极流入,电子只能经过导线.
解答 解:A、根据原电池和电解池的工作原理,电解池中阴离子向阳极移动;在原电池中阴离子向负极移动,故A错误;
B、电解池中阳极、原电池的负极发生氧化反应,原电池的正极、电解池中阴极发生还原反应,故B正确;
C、电解池中连接电源正极的为阳极,故C正确;
D、原电池中电子由负极流出,正极流入,电子只能经过导线,在电解池中,电子从电源的负极流出到达阴极,从阳极流出回到电源的正极,故D正确.
故选A.
点评 本题考查学生原电池和电解池的工作原理知识,属于教材基本知识的考查,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.在密闭容器中进行X2(g)+Y2(g)═2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,反应达到平衡时,各物质浓度可能是( )
| A. | c(X)=0.2mol?L-1 | B. | c(Y2)=0.35mol?L-1 | C. | c(Y2)=0.2mol?L-1 | D. | c(Z)=0.4mol?L-1 |
12.下列有关叙述正确的是( )
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在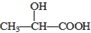 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越强 |
9.下列的比较关系不正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合后溶液中离子浓度关系:c(H+)+c(M+)=c(OH-)+c(A-) | |
| B. | 相等浓度的CH3COONa、NaOH和NaHCO3三种溶液的pH:pH(CH3COONa)>pH (NaHCO3)>pH(NaOH) | |
| C. | 0.1mol•L-1的NaHA溶液,其pH=4:c(Na+)>c(HA-)>c(H+)>c(A2-)>c (H2A) | |
| D. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,溶液成酸性:c(CH3COO-)>c(CH3COOH) |
16.将分别盛有熔融NaCl、MgCl2、Al2O3(熔有冰晶石)的三个电解槽,在一定条件下通电一段时间后,析出Na、Mg、Al的物质的量之比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
6.在一定温度下,容积不变的密闭容器里,能说明A(g)+3B(g)?2C(g)达到平衡状态的标志是( )
| A. | 单位时间生成nmol A的同时生成3n mol | |
| B. | B.容器内压强不随时间的变化而变化 | |
| C. | A,B,C的浓度相等的状态 | |
| D. | A,B,C的分子个数比为1:3:2 |
10.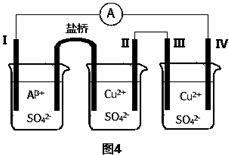 某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
 某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )
某同学组装了如图所示的电化学装置,电极ⅠAl,其它均为Cu,则下列正确的是( )| A. | 电流方向:电极Ⅳ→A→电极Ⅰ | B. | 电极Ⅰ发生还原反应 | ||
| C. | 电极Ⅱ逐渐溶解 | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
11.下列有关周期表的说法中,正确的是( )
| A. | 每个主族都含有非金属元素 | B. | 构成半导体的元素都是非金属元素 | ||
| C. | 过渡元素都属于金属元素 | D. | 非金属元素都位于短周期 |