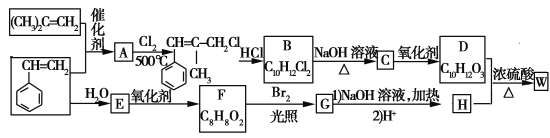
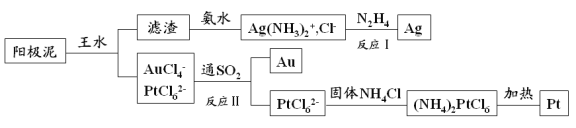
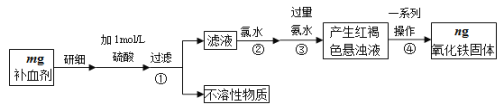
题目内容
【题目】A、B、C、D四种元素。原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的 L层电子数等于K、M两个电子层上的电子数之和。
(1)A为_______________元素,B为_______________元素;C为_______________元素。D的质子数和中子数相等,D的原子组成符号为_____________,它的最高价为__________价。
(2)用电子式表示A、D两元素形成AD2的过程:______________________________,用电子式表示C、D两元素形成化学键的过程:______________________________。
(3)写出E和A的最高价氧化物反应的化学方程式:________________________________。
【答案】(1)碳 氧 钠![]() +6(2)
+6(2)![]()
![]()
(3)2Na2O2+2CO2====2Na2CO3+O2
【解析】试题分析:因B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,可知E为过氧化钠,B为氧元素,C为钠元素;D的L层电子数 等于K、M两个电子层上的电子数之和,所以K、L、M三个电子层上的电子数分别为2、8、6,可知D为硫元素;A、B、C、D四种元素,原子序数依次增 大,A原子的最外层上有4个电子,可知A为碳元素;
(1)由以上分析可得A为碳,B为氧元素,C为钠元素,D的原子组成符号为![]() ,它的最高价为+6价。
,它的最高价为+6价。
(2)A、D两元素形成AD2是二氧化碳,其形成过程为:![]() ,C、D两元素形成的化合物是硫化钠,形成过程是:
,C、D两元素形成的化合物是硫化钠,形成过程是:![]() 。
。
(3)E是过氧化钠,A的最高价氧化物是二氧化碳,反应的化学方程式:2Na2O2+2CO2====2Na2CO3+O2。