题目内容
【题目】以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。

①若从左端分别通入SO2和Cl2,装置A中观察到的现象 (填“相同”或“不相同”);若装置D中装的是V2O5(催化剂)。通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,溶液颜色褪去,则该反应的离子方程式为 。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入加量(填字母) ,能产生白色沉淀。
A.氨水 B.稀盐酸 C.硝酸钾溶液 D.氯化钠溶液
(3)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为2∶3;当Cl2的与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
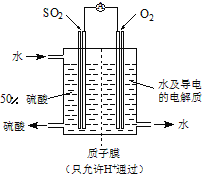
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2的电极为 极,其电极反应式为 ;电池的总反应式 。
【答案】(1)①相同 2SO2+O2![]() 2SO3;②SO2+I2+2H2O=4H++2I-+SO42-
2SO3;②SO2+I2+2H2O=4H++2I-+SO42-
(2)AC;
(3)Cl2+SO32-+H2O=SO42-+2Cl-+2H+;
(4)负;SO2 -2e-+2 H2O== SO42-+4H+; 2SO2+O2+2H2O=2H2SO4。
【解析】
试题分析:(1)①二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色;若装置D中装的是V2O5(催化剂)。通入SO2时,打开K通入适量O2,它们会发生氧化还原反应产生SO3,该反应是可逆反应,所以反应的化学反应方程式为 2SO2+O2![]() 2SO3;②SO2通入B的碘水中,二者会发生氧化还原反应而使溶液颜色褪去,则该反应的离子方程式为SO2+I2+ 2H2O=4H++2I-+SO42-;(3)将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应。A.氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,正确;B.稀盐酸加入后不反应,错误;C.稀硝酸溶液具有强氧化性,将二氧化硫氧化成硫酸根,与钡离子生成硫酸钡沉淀,正确;D.氯化钙溶液和二氧化硫不反应,错误;(3) 若由元素S和O组成-2价酸根离子X,X中S和O的质量比为2:3,则二者的原子个数比是:1:3,该微粒是SO32-,当Cl2的与含X的溶液完全反应后,反应产生硫酸根离子积Cl-,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色BaSO4沉淀产生。Cl2与含X的溶液反应的离子方程式是Cl2+SO32-+H2O=SO42-+2Cl-+2H+;(4)利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2失去电子,发生氧化反应,所以通入SO2的电极为负极,其电极反应式为SO2 -2e-+2 H2O== SO42-+4H+;通入空气的电极为正极,氧气获得电子,与溶液的氢离子结合形成水,所以电池的总反应式是2SO2+O2+2H2O=2H2SO4。
2SO3;②SO2通入B的碘水中,二者会发生氧化还原反应而使溶液颜色褪去,则该反应的离子方程式为SO2+I2+ 2H2O=4H++2I-+SO42-;(3)将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量试剂仍然无法观察到沉淀产生,说明不发生反应。A.氨水加入后生成亚硫酸铵,亚硫酸根和钡离子生成沉淀,正确;B.稀盐酸加入后不反应,错误;C.稀硝酸溶液具有强氧化性,将二氧化硫氧化成硫酸根,与钡离子生成硫酸钡沉淀,正确;D.氯化钙溶液和二氧化硫不反应,错误;(3) 若由元素S和O组成-2价酸根离子X,X中S和O的质量比为2:3,则二者的原子个数比是:1:3,该微粒是SO32-,当Cl2的与含X的溶液完全反应后,反应产生硫酸根离子积Cl-,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色BaSO4沉淀产生。Cl2与含X的溶液反应的离子方程式是Cl2+SO32-+H2O=SO42-+2Cl-+2H+;(4)利用电化学原理用SO2来制备硫酸,装置如图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入SO2失去电子,发生氧化反应,所以通入SO2的电极为负极,其电极反应式为SO2 -2e-+2 H2O== SO42-+4H+;通入空气的电极为正极,氧气获得电子,与溶液的氢离子结合形成水,所以电池的总反应式是2SO2+O2+2H2O=2H2SO4。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案