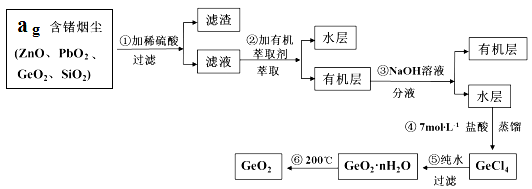
题目内容
【题目】实验室制备环己酮的反应原理:

其反应的装置示意图如下(夹持装置、加热装置略去):

环己醇、环己酮、饱和食盐水和水的部分物理性质见下表(注:括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
物质 | 沸点(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
环己醇 | 161.1(97.8) | 0.962 | 能溶于水 |
环己酮 | 155.6(95) | 0.948 | 微溶于水 |
饱和食盐水 | 108.0 | 1.330 | |
水 | 100.0 | 0.998 |
(1)实验中通过装置B将酸性Na2Cr2O7溶液加到盛有环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
① 仪器B的名称是 。
② 蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是 。
③ 蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~ 156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
① 上述操作的正确顺序是 (填序号)。
② 在上述操作c中,加入NaCl固体的作用是 。
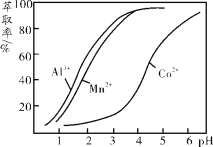
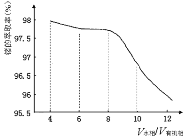
(3)环己酮是一种常用的萃取剂,以环己酮为成分之一的萃取液对金属离子的萃取率与pH的关系如上图。现有某钴矿石的盐酸浸出液, 浸出液含有的阳离子主要有H+、Co2+、Mn2+、Al3+,除去Al3+ 后,再利用萃取法分离出MnCl2以得到较为纯净的CoCl2溶液,pH范围控制在 。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(4)在实验中原料用量:20mL环己醇、酸性Na2Cr2O7溶液10mL,最终称得产品质量为14.7g,则所得环己酮的产率为 (百分数精确到0.1)。
(5)实验产生的含铬废液易污染环境,可将Cr2O72-转化为Cr3+,再转化为Cr(OH)3沉淀除去,为使Cr3+浓度小于1×10-5mol/L,应调节溶液的pH=___________。(已知该条件下Cr(OH)3的Ksp是6.4×10-31, lg2=0.3 lg5=0.7)
【答案】(1)①分液漏斗 (1分) ②停止加热,冷却后通自来水 (1分)
③环已酮和水形成具有固定组成的恒沸物一起蒸出 (2分)
(2)①c d b a (2分) ②降低环己酮在水中的溶解度,减少产物的损失;增加水层的密度,有利于分层 (2分) (3)b (2分) (4)78.0% (2分) (5)5.6 (2分)
【解析】
试题分析:(1)①根据仪器构造可知仪器B的名称是分液漏斗;
②蒸馏操作时,一段时间后发现未通冷凝水,不能立即接通冷凝水,防止骤冷将冷凝管炸裂,应该等到装置冷却后再通冷凝水;
③环己酮和水能形成具有固定组成的混合物,具有固定的沸点,蒸馏时能被一起蒸出,所以蒸馏难以分离环己酮和水的混合物.环己酮和水能够产生共沸,采取蒸馏是不可取的,建议采用精馏;
(2)①联系制取肥皂的盐析原理,即增加水层的密度,有利于分层,环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,除去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,故答案为:c d b a;
②加入NaCl固体,降低环己酮在水中的溶解度,减少产物的损失。同时使水溶液的密度增大,将水与有机物更容易分离开来;
(3)由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,故答案为:b;
(5)根据氢氧化铬的溶度积常数可知Cr3+浓度=1×10-5mol/L时溶液中氢氧根的浓度是![]() =4×10-9mol/L,则溶液中氢离子浓度是2.5×10-6mol/L,因此溶液的pH=5.6,即应调节溶液的pH为5.6。
=4×10-9mol/L,则溶液中氢离子浓度是2.5×10-6mol/L,因此溶液的pH=5.6,即应调节溶液的pH为5.6。

 名校课堂系列答案
名校课堂系列答案