题目内容
【题目】I.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。
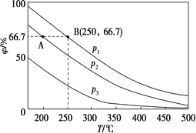
①其中,p1、p2 和p3 由大到小的顺序是____________,该反应ΔH _______0(填“>”“<”或“=”)。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_______Pa (分压=总压×物质的量分数,保留一位小数)。
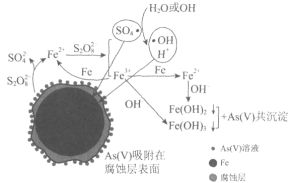
Ⅲ.以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
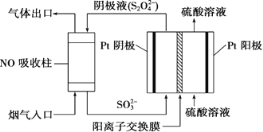
(3)①阴极区的电极反应式为___________。
②NO吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ.(4)常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
【答案】高温 +247.1 p1>p2>p3 < < 8.3×103 2SO32-+4H++2e-=S2O42-+2H2O 1344 ![]()
【解析】
I.(1)反应自发进行的条件是△H-T△S<0,
水蒸气重整:CH4(g)+H2O(g)CO(g)+3H2(g)△H1=+205.9kJmol-1①
CO(g)+H2O(g)CO2(g)+H2(g)△H2=-41.2kJmol-1②
二氧化碳重整:CH4(g)+CO2(g)2CO(g)+2H2(g)△H3③
盖斯定律计算①-②得到反应③的热化学方程式;
Ⅱ.(2)①由方程式N2+3H22NH3可知,增大压强,平衡正向移动,氨的体积分数越大;
②温度越大,压强越大,反应速率越大;
③用三段式解,设转化的氮气的物质的量为x:

![]() =0.667,x=0.08。平衡分压=总压×气体物质的量分数;
=0.667,x=0.08。平衡分压=总压×气体物质的量分数;
(3)①阴极区失去电子生成S2O42-;
②结合NO~NH4+~5 e-计算。
Ⅳ.(4)溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算.
I.(1)水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①,△H>0,△S>0,满足△HT△S<0,则需要高温。
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①,△H>0,△S>0,满足△HT△S<0,则需要高温。
水蒸气重整CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3③
2CO(g)+2H2(g) ΔH3③
盖斯定律计算①-②得到反应③的热化学方程式CH4(g)+CO2(g)2CO(g)+2H2(g)△H3=+247.1KJ/mol,
故答案为:高温;+247.1;
II.(2)①由N2+3H22NH3可知,增大压强,平衡正向移动,由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为p1>p2>p3,因此压强关系是p1>p2>p3,压强相同时,升高温度平衡逆向移动,故温度越高平衡混合物中氨的体积分数越小,故反应热小于零,
故答案为:p1>p2>p3;<;
②温度越,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大,
故答案为:<;
③③用三段式解,设转化的氮气的物质的量为x:

![]() =0.667,x=0.08。
=0.667,x=0.08。
若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)=![]() =8.3×103,
=8.3×103,
故答案为:8.3×103;
III.(3)①由图可知,阴极区通入液体主要含SO32,流出液主要含S2O42,所以阴极区电极反应式为SO32-+4H++2e-=S2O42-+2H2O,
故答案为:SO32-+4H++2e-=S2O42-+2H2O;
②由于NO吸收转化后的主要产物为NH4+,NONH4+5e,若电路中转移0.3mole,消耗NO0.06mol,标准状况下体积为=0.06mol×22.4L/mol=1.344L=1344mL,
故答案为:1344。
Ⅳ. (4)反应平衡时,2c(Ba2+)=c(CH3COO)=bmol/L,据电荷守恒,溶液中c(H+)=c(OH)=107mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K= ![]() =
=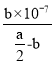 =
= ![]() ;
;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为![]() ,
,
故答案为:![]() 。
。

【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
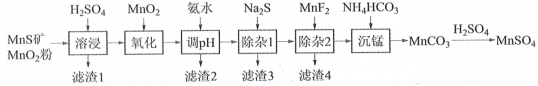
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀![]() pH范围如下:
pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8 3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)写出基态锰原子核外电子排布式___。
(2)“氧化”中添加适量的MnO2发生反应的离子方程式是___。
(3)“调pH”除铁和铝,溶液的pH范围应调节为___~6之间。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___。
(5)写出“沉锰”的离子方程式___。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
【题目】补充完成下表:(请把序号①~⑦的答案填在相应的位置上)
元素 | 甲 | 乙 | 丙 |
元素符号 | ①______ | ②______ | O |
原子结构示意图 |
| ③______ | ④______ |
周期 | 三 | 三 | ⑤______ |
族 | ⑥______ | ⅦA | ⑦______ |