题目内容
【题目】氨是重要的化工原料,用途很广。
![]() 合成氨工厂常用醋酸二氨合铜
合成氨工厂常用醋酸二氨合铜![]() 由
由![]() 和
和![]() 构成
构成![]() 溶液吸收对氨合成催化剂有毒害的CO气体。
溶液吸收对氨合成催化剂有毒害的CO气体。
![]() 醋酸二氨合铜所含的元素中,第一电离能最大的是 ______
醋酸二氨合铜所含的元素中,第一电离能最大的是 ______ ![]() 填元素名称
填元素名称![]() 。
。
![]() 醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______
醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 ______ ![]() 填标号
填标号![]() 。
。
![]() 离子晶体
离子晶体![]() 分子晶体
分子晶体![]() 原子晶体
原子晶体![]() 金属晶体
金属晶体
![]() 第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种
第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 ______ 种![]() 不含
不含![]() 。
。
![]() 气体与
气体与![]() 相遇立即生成一种白色晶体:
相遇立即生成一种白色晶体:![]() 。
。
![]() 和
和![]() 分子的空间构型分别为 ______ 、 ______ 。
分子的空间构型分别为 ______ 、 ______ 。
![]() 晶体
晶体![]() 中,B原的杂化轨道类型为 ______ 。
中,B原的杂化轨道类型为 ______ 。
![]() 可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为
可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为![]() 的物质。该物质易溶于水,在水溶液中以
的物质。该物质易溶于水,在水溶液中以![]() 和
和![]() 两种正四面体构型的离子存在。
两种正四面体构型的离子存在。![]() 遇碱生成一种形似白磷的
遇碱生成一种形似白磷的![]() 分子。
分子。
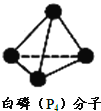
![]() 下列相关说法中,正确的是 ______
下列相关说法中,正确的是 ______ ![]() 填序号
填序号![]() 。
。
![]() 是
是![]() 的同分异构体
的同分异构体
![]()
![]() 分解生成
分解生成![]() ,形成了4mol
,形成了4mol![]() 键
键
![]() 白磷的沸点比
白磷的沸点比![]() 高,原因是
高,原因是![]() 键键能比
键键能比![]() 键大
键大
![]() 白磷的化学性质比
白磷的化学性质比![]() 活泼,说明P的非金属性比N强
活泼,说明P的非金属性比N强
![]() 画出
画出![]() 的结构
的结构![]() 标明其中的配位键
标明其中的配位键![]() : ______ 。
: ______ 。
【答案】氮 b、c、d 4 正三角形 三角锥型 ![]() b
b 
【解析】
![]() 非金属性越强,第一电离能越大,但是最外层电子排布处于全满或半满状态时较稳定,不易失电子,第一电离能较大,醋酸二氨合铜所含的元素有Cu、O、C、H、N,由于N原子的2p能级为半满状态,第一电离能较大,所以第一电离能最大的是N;
非金属性越强,第一电离能越大,但是最外层电子排布处于全满或半满状态时较稳定,不易失电子,第一电离能较大,醋酸二氨合铜所含的元素有Cu、O、C、H、N,由于N原子的2p能级为半满状态,第一电离能较大,所以第一电离能最大的是N;
故答案为:氮;
![]() 醋酸二氨合铜所含元素组成的单质,有铜属于金属晶体,金刚石属于原子晶体,氮气、氧气和氢气属于分子晶体;
醋酸二氨合铜所含元素组成的单质,有铜属于金属晶体,金刚石属于原子晶体,氮气、氧气和氢气属于分子晶体;
故答案为:b、c、d;
![]() 的外围电子排布为
的外围电子排布为![]() ,只有1个未成对电子,第4周期元素中,基态原子含有一个未成对电子的元素有K、Sc、Ga、Br,共有4种元素;
,只有1个未成对电子,第4周期元素中,基态原子含有一个未成对电子的元素有K、Sc、Ga、Br,共有4种元素;
故答案为:4;
![]() 中B的价层电子对数为
中B的价层电子对数为![]() ,没有孤电子对,分子的空间构型为正三角形,
,没有孤电子对,分子的空间构型为正三角形,![]() 分子中N原子的价层电子对数为
分子中N原子的价层电子对数为![]() ,含有一对孤电子对,空间构型为三角锥型;
,含有一对孤电子对,空间构型为三角锥型;
故答案为:正三角形;三角锥型;
![]() 晶体
晶体![]() 中,B原子的价层电子对数为4,则杂化类型为
中,B原子的价层电子对数为4,则杂化类型为![]() 杂化;
杂化;
故答案为:![]() ;
;
![]() 分子式相同结构不同的化合物互称同分异构体,
分子式相同结构不同的化合物互称同分异构体,![]() 与
与![]() 都是N元素的单质,属于同素异形体,故a错误;
都是N元素的单质,属于同素异形体,故a错误;
![]() 一个
一个![]() 中含有2个
中含有2个 ![]() 键,
键,![]() 分解生成
分解生成![]() ,形成了4molπ键,故b正确;
,形成了4molπ键,故b正确;
![]() 结构相似的分子晶体,相对分子质量越大,熔沸点越高,白磷的相对分子质量比
结构相似的分子晶体,相对分子质量越大,熔沸点越高,白磷的相对分子质量比![]() 大,故白磷的沸点比N4高,与键能无关,故c错误;
大,故白磷的沸点比N4高,与键能无关,故c错误;
![]() 同主族从上到下,非金属性减弱,则P的非金属性比N弱,白磷的化学性质比
同主族从上到下,非金属性减弱,则P的非金属性比N弱,白磷的化学性质比![]() 活泼,与共价键稳定性有关,故d错误;
活泼,与共价键稳定性有关,故d错误;
故答案为:b;
![]() 中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键,则
中每个N原子与另外3个N原子形成共价键,同时与1个氢离子形成配位键,则![]() 的结构图为
的结构图为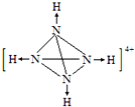 ;
;
故答案为: 。
。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】实验室制乙酸乙酯的主要装置如图中A所示,主要步骤:
①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液:
④等b试管中收集到约2 mL产物时停止加热。撤下b试管并用力振荡, 然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯。
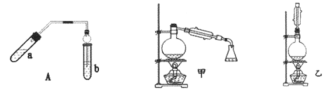
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:_______
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用______;步骤⑤中分离乙酸乙酯必须使用的一种仪器是____。
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图A所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18mol | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3mol | 1.2 | |
D | 3 mL乙醇、2 mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入6mL浓度为__mol·L-1 盐酸。
②分析对比实验_____(填实验编号)的数据,可推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
③为充分利用反应物,该同学又设计了图中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为更合理的是_______理由是:________