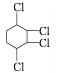
题目内容
【题目】(1)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和减去反应中形成新化学键的键能之和。下面列举了一些化学键的键能数据,供计算使用。
化学键 | Si—O | Si—Cl | H-H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
已知:1mol晶体硅含有2molSi-Si键。工业上可以通过下列反应制取高纯硅:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),则该反应的反应热(ΔH)为______。
(2)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
①有机物M经过太阳光光照可转化成N,转化过程如下:
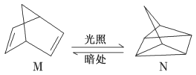 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M的化学式为_________________,M、N相比,较稳定的是____________。(填M或N)
②已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a____________238.6(填“>”、“<”或“=”)。
③使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________。
④火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子时放出的热量为_______。
(3)已知:
①H2O(g)=H2O(l) △H1=—Q1kJ/mol
②CH3OH(g)=CH3OH(l) △H2=—Q2kJ/mol
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=—Q3kJ/mol(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为______kJ。
【答案】![]() C7H8 M <
C7H8 M < ![]()
![]() 98kJ
98kJ ![]()
【解析】
(1)信息可知,△H=反应物的总键能-生成物的总键能,则![]() ,该反应的反应热
,该反应的反应热![]() 故答案为:
故答案为:![]() ;
;
(2)①根据M的键线式可知M化学式为:C7H8;有机物M经过太阳光光照可转化成N:ΔH=+88.6 kJ·mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定。
故答案为:C7H8;M;
②燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热。
故答案为:<;
③有1molCl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:![]()
![]() 。
。
故答案为:![]()
![]() ;
;
④![]() 转移12mol电子放热1176kJ,则反应过程中,每转移1mol电子放热1176kJ÷12=98kJ。
转移12mol电子放热1176kJ,则反应过程中,每转移1mol电子放热1176kJ÷12=98kJ。
故答案为:98kJ;
(3)已知:①H2O(g)=H2O(l) △H1=—Q1kJ/mol
②CH3OH(g)=CH3OH(l) △H2=—Q2kJ/mol
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=—Q3kJ/mol(Q1、Q2、Q3均大于0)
由盖斯定律可得![]() 可得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)
可得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)![]() ,32g甲醇物质的量为1mol,故释放的热量为:
,32g甲醇物质的量为1mol,故释放的热量为:![]() kJ。
kJ。
故答案为:![]() 。
。

【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示。已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;②有关有机物物的沸点如下表:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
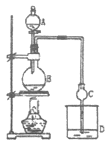
A中放醋酸,B中将过量的乙醇与少量浓硫酸混合,D中放有饱和碳酸钠溶液,经分液漏斗边滴加醋酸、边加热。
请回答:
(1)反应混合物的配制:圆底烧烧瓶中先加入___,再逐滴加入___,边加边振荡,___后,再加入醋酸。
(2)反应中加入的乙醇是过量的,其目的是___;浓硫酸的作用:①___;②___。
(3)该反应中,若用CH3CH218OH与乙酸发生反应,则反应的化学方程式为___。
(4)加热除了加快反应速率外还有一个重要的目的:___。
(5)在装置中,球形干燥管主要起到两个作用:一是起冷凝作用,二是:___。
(6)试管中盛放的是饱和碳酸钠溶液,它的作用是___(选填编号)。
A.中和乙酸和乙醇 B.吸收乙酸并溶解乙醇
C.降低乙酸乙酯的溶解度,有利于析出 D.加速乙酸乙酯的生成,提高其产率
(7)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___;再加入___(此空从下列选项中选择),目的是___,然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.碱石灰 B.无水硫酸钠 C.生石灰
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A. | 向 | 黄色逐渐消失,加 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C. | 将足量的 | 酸性 |
|
D. | 将 | 先有白色沉淀生成,后变为蓝色沉淀 |
|
A.AB.BC.CD.D
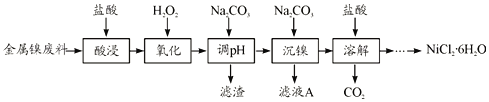
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。