题目内容
【题目】下图是一个化学过程的示意图,请回答下列问题:
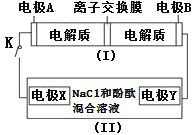
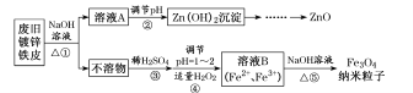
(1)图中甲池是____________装置,乙池是______________装置。
(2)D电极的名称是______________,A电极的名称是_______________。
(3)通入O2的电极的电极反应式为___________,通入CH4的电极的电极反应式为_________。
(4)丙池中反应的化学方程式为__________________。
(5)当乙池中B(Ag)极的质量增加4.32g时,甲池中理论上消耗O2______________________mL(标准状况下)。
【答案】原电池 电解池 阴极 阳极 ![]()
![]()
![]() 224
224
【解析】
甲池为燃料电池,通入甲烷的电极为负极,通入氧气的电极为正极;乙池为电解池,A与原电池正极相连为阳极,B为阴极;丙池为电解池,C为阳极,D为阴极,据此根据电子守恒分析回答。
甲池为燃料电池,通入燃料的电极为负极,电极反应为:![]() ,通入氧气的电极为正极,电极反应为:
,通入氧气的电极为正极,电极反应为:![]() ;乙池为电解池,A与原电池正极相连为阳极,电极反应为:
;乙池为电解池,A与原电池正极相连为阳极,电极反应为:![]() ;B为阴极,电极反应为:
;B为阴极,电极反应为:![]() ;丙池为电解池,C为阳极,电极反应为:
;丙池为电解池,C为阳极,电极反应为:![]() ,D为阴极,电极反应为:
,D为阴极,电极反应为:![]() 。
。
(1)甲池为原电池装置,乙池为电解池装置,故答案为:原电池;电解池;
(2)D为阴极,A为阳极,故答案为:阴极;阳极;
(3)通入甲烷的电极为负极,发生氧化反应,电极反应为:![]() ,通入氧气的电极为正极,发生还原反应,电极反应为:
,通入氧气的电极为正极,发生还原反应,电极反应为:![]() ;
;
(4)丙池为电解氯化钠溶液,总反应方程式为:![]() ;
;
(5)当乙池中B(Ag)极的质量增加4.32g时,根据电极反应![]() ,转移电子是
,转移电子是![]() ,由于电子守恒和电极反应
,由于电子守恒和电极反应![]() 可知氧气的物质的量为0.01mol,则消耗氧气的体积为
可知氧气的物质的量为0.01mol,则消耗氧气的体积为![]() ,故答案为:224。
,故答案为:224。

【题目】(1)通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和减去反应中形成新化学键的键能之和。下面列举了一些化学键的键能数据,供计算使用。
化学键 | Si—O | Si—Cl | H-H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
已知:1mol晶体硅含有2molSi-Si键。工业上可以通过下列反应制取高纯硅:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),则该反应的反应热(ΔH)为______。
(2)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
①有机物M经过太阳光光照可转化成N,转化过程如下:
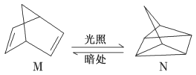 ΔH=+88.6 kJ·mol-1
ΔH=+88.6 kJ·mol-1
则M的化学式为_________________,M、N相比,较稳定的是____________。(填M或N)
②已知CH3OH(l)的燃烧热为238.6 kJ·mol-1,CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a____________238.6(填“>”、“<”或“=”)。
③使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:____________。
④火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1176 kJ·mol-1,则反应过程中,每转移1 mol电子时放出的热量为_______。
(3)已知:
①H2O(g)=H2O(l) △H1=—Q1kJ/mol
②CH3OH(g)=CH3OH(l) △H2=—Q2kJ/mol
③2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H3=—Q3kJ/mol(Q1、Q2、Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为______kJ。
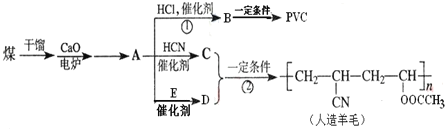
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
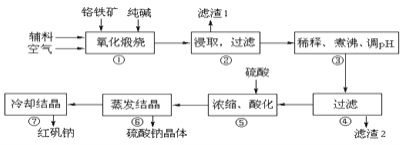
①中涉及的主要反应有:
主反应:![]()
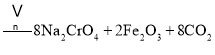
副反应: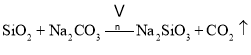 、
、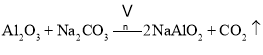
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
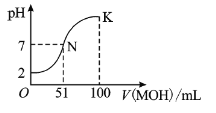
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .