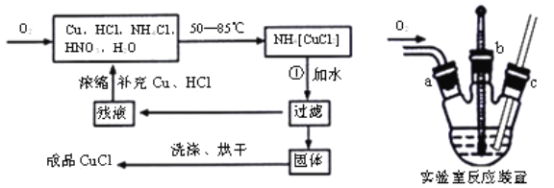
题目内容
【题目】铝土矿(主要成分为Al2O3,还有MgO等少量杂质)。提取铝的工业流程如下:
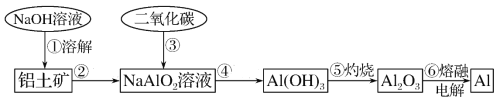
(1)铝是活泼金属,在干燥空气中铝的表面立即形成厚约5nm的致密氧化膜,写出用盐酸除去氧化膜的化学方程式___。
(2)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因______(用方程式说明),写出第②步用到的玻璃仪器______。
(3)请用离子方程式表示以上工艺流程中第①步反应:__。
(4)实验室常选用试剂__(填写字母,a.氢氧化钠溶液,b.氨水)与硫酸铝溶液反应制取氢氧化铝,原因是__。
(5)写出氢氧化铝的其他用途(任写两条)__。
【答案】Al2O3+6HCl=2AlCl3+3H2O 2Al(OH)3![]() Al2O3+H2O 玻璃棒、烧杯 Al2O3+2OH-=2AlO2-+H2O a 氢氧化钠溶液要溶解氢氧化铝,而氨水是弱碱,与氢氧化铝不反应 胃酸中和剂、净水剂
Al2O3+H2O 玻璃棒、烧杯 Al2O3+2OH-=2AlO2-+H2O a 氢氧化钠溶液要溶解氢氧化铝,而氨水是弱碱,与氢氧化铝不反应 胃酸中和剂、净水剂
【解析】
(1)氧化铝和盐酸反应生成氯化铝和水;
(2)阻燃剂,赋予易燃聚合物难燃性的功能性助剂;
(3)铝土矿中加入氢氧化钠溶液,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水;
(4)实验室中制取氢氧化铝一般用铝盐和氨水;
(5)氢氧化铝具有弱碱性,可中和胃酸,氢氧化铝具有吸附性,可做净水剂;
(1)氧化铝和盐酸反应生成氯化铝和水,反应的方程式为:Al2O3+6HCl=2AlCl3+3H2O;
(2)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,是因为2Al(OH)3![]() Al2O3+H2O,生成的氧化铝具有很高的熔点;第②步用到的玻璃仪器为烧杯和玻璃棒;
Al2O3+H2O,生成的氧化铝具有很高的熔点;第②步用到的玻璃仪器为烧杯和玻璃棒;
(3)铝土矿中加入氢氧化钠溶液,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,反应方程式为:Al2O3+2NaOH-=2NaAlO2+H2O,离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
(4)因氢氧化铝能溶于强碱,不溶于弱碱,因此实验室中制取氢氧化铝一般用铝盐和氨水,选择b;
(5)氢氧化铝具有弱碱性,可中和胃酸,氢氧化铝具有吸附性,可做净水剂;

【题目】异丁烷脱氢制异丁烯反应为:![]()
副反应为裂解反应:![]()
![]() 已知:
已知:
化学键 | | | | |
键能 | 412 | 348 | 612 | 436 |
试计算异丁烷脱氢反应的![]() ______
______![]()
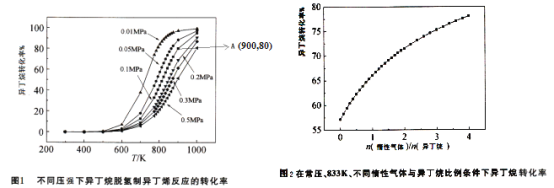
![]() 不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
A.主反应和副反应均在低温条件下自发
B.开发高选择性的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
C.由图1可知,![]() 范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
D.选择合适的温度,使催化剂的活性最大,有利于提高异丁烷的平衡转化率
![]() 平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替
平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替![]() 分压
分压![]() 物质的量分数
物质的量分数![]() 总压强
总压强![]() 。图1中,A点状态下的异丁烷脱氢反应的平衡常数
。图1中,A点状态下的异丁烷脱氢反应的平衡常数![]() ______
______![]() 保留两位有效数字
保留两位有效数字![]() 。
。
![]() 常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
![]() 请在图2中画出温度为
请在图2中画出温度为![]() ,其他条件不变时,异丁烷转化率图象。
,其他条件不变时,异丁烷转化率图象。
![]() 科学家发现,以
科学家发现,以![]() 和
和![]() 为原料,熔融
为原料,熔融![]() 为电解质,纳米
为电解质,纳米![]() 作催化剂,在
作催化剂,在![]() 和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和![]() 。
。
【题目】298 K时,![]() γ-羟基丁酸水溶液发生如下反应,生成
γ-羟基丁酸水溶液发生如下反应,生成![]() 丁内酯: HOCH2CH2CH2COOH
丁内酯: HOCH2CH2CH2COOH![]()
![]() +H2O
+H2O
不同时刻测得![]() 丁内酯的浓度如下表。
丁内酯的浓度如下表。
| 20 | 50 | 80 | 100 | 120 | 160 | 220 | ∞ |
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
注:该条件下副反应、溶液体积变化忽略不计。下列分析正确的是
A.增大γ-羟基丁酸的浓度可提高γ-丁内酯的产率
B.298 K时,该反应的平衡常数为2.75
C.反应至120 min时,γ-羟基丁酸的转化率<50%
D.80~120 min的平均反应速率:v(γ-丁内酯) >1.2×10-3 mol L-1min-1