题目内容
【题目】医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OH![]() HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
HCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是
A.含NA个ClO-的NaClO溶液中,Na+数目为NA
B.上述反应中,每生成1molNaCl,转移的电子数为8NA
C.100 g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA
【答案】B
【解析】
A.NaClO中ClO-在水溶液中会发生水解,所以含NA个ClO-的NaClO溶液中,Na+数目大于NA,故A错误;
B.该反应中Cl元素从+1价降到-1价,每生成1molNaCl,消耗4molNaClO,转移的电子数为8NA,故B正确;
C.乙醇溶液中,乙醇分子、水分子都含有氢原子,100g46%的乙醇溶液中乙醇的物质的量为1mol,含6molH原子;含水的质量为54g,物质的量为3mol,也含6molH原子,故此溶液中含H原子为12NA个,故C错误;
D.标准状况下HCCl3为液态,2.24 LHCCl3不是0.1mol,故D错误;
故答案选B。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。请回答下列问题:
(1)利用焰色反应可以定性鉴别某些金属盐。灼烧SrSO4时,锶的焰色为_____(填标号)。 A.洋红色 B.浅紫色 C.黄绿色 D.淡蓝色
(2)硫化锶(SrS)可用作发光涂料的原料,SrSO4和碳的混合粉末在隔绝空气下高温焙烧可生成硫化锶和一种还原性气体, 该反应的化学方程式____________________________。
(3)已知:25℃时,K sp(SrSO4)=3.2×10-7,K sp(SrCO3)=1.1×10-10。SrSO4的粉末与Na2CO3溶液混合加热、充分搅拌可生成硫酸钠和碳酸锶,若转化完成时恢复到25℃,混合液中c(CO![]() )=1.0×10-3mol/L,则c(SO
)=1.0×10-3mol/L,则c(SO![]() )=______________________。
)=______________________。
(4)以天青石生产Sr(OH)2·xH2O的工艺如下:

已知: Sr(OH)2 、Ca(OH)2在水中的溶解度如下表:
温度/(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①滤渣2为混有CaCO3的SrCO3,写出反应1生成SrCO3的化学方程式______________。
②固体3 “加热水浸”是为了获得较纯净的Sr(OH)2溶液/span>,此时应缓慢加热使沉淀颗粒长大,滤渣5的主要成分是______(填化学式),“趁热过滤”的目的是_________________________________。
③“操作6”主要有:________________、过滤、洗涤、干燥。
④取m g纯净Sr(OH)2·x H2O产品溶于水,加入过量Na2CO3溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=__________(用含m、n的式子表示)。
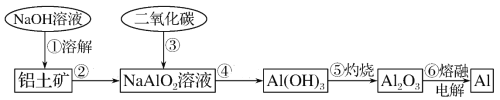
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

下列说法不正确的是
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl- = Fe2++ TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
温度/ | 30 | 35 | 40 | 45 | 50 |
TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
D.TiO2 ·xH2O沉淀与双氧水、氨水反应40min所得实验结果如上表所示, 40 oC前,未达到平衡状态,随着温度升高,转化率变大
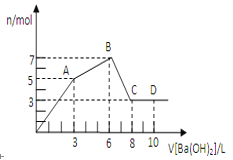
【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
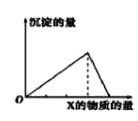
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D