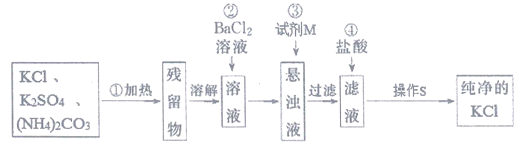
题目内容
【题目】下列实验现象预测正确的是

A. 实验I:振荡后静置,上层溶液颜色保持不变
B. 实验II:酸性KMnO4溶液中无明显现象
C. 实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
【答案】D
【解析】试题分析:A、溴与氢氧化钠溶液反应生成溴化钠、次溴酸钠和水,振荡后静置,上层溶液颜色褪去,错误;B、浓硫酸具有脱水性、强氧化性,滴入蔗糖中会使蔗糖脱水碳化,进而反应生成二氧化碳、二氧化硫和水,二氧化硫具有还原性,酸性KMnO4溶液褪色,错误;C、微热稀HNO3和铜反应生成硝酸铜、一氧化氮和水,溶液中有气泡产生,一氧化氮与空气中的氧气反应生成红棕色的二氧化氮气体,错误;D、该实验Ⅳ:将氯化铁饱和溶液滴入沸水中,继续煮沸溶液至红褐色,停止加热,制得氢氧化铁胶体,当光束通过体系时可产生丁达尔效应,正确。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解。
(1)已知:
化学键 | 断开1mol化学键所需的能量(kJ) |
H-H | 436 |
O-H | 463 |
O=O | 498 |
①H2O的电子式是________________。
②H2O(g)分解的热化学方程式是________________________。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出__________kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 | |
a | 50 mL5%H2O2溶液 | 1 mL0.1 mol·L-1FeCl3溶液 | |
b | 50 mL5%H2O2溶液 | 少量浓盐酸 | 1 mL0.1 mol·L-1FeCl3溶液 |
c | 50 mL5%H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
d | 50 mL5%H2O2溶液 | MnO2 | |
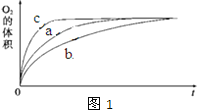
① 测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。由该图能够得出的实验结论是______________________。
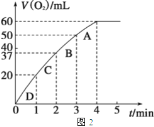
② 测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因________________;计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。