题目内容
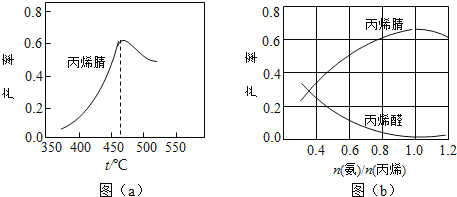
【题目】已知反应:2NO2(g)N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用止水夹夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是
A. 上述过程中,A烧瓶内正、逆反应速率均加快
B. 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大
C. 上述过程中,A、B烧瓶内气体密度均保持不变
D. 反应2NO2(g)N2O4(g)的逆反应为放热反应
【答案】D
【解析】试题分析:升高温度,正、逆反应速率都增大, A正确;B烧瓶内气体颜色变浅,说明平衡向生成N2O4方向移动,B烧瓶内c(NO2)减小,c(N2O4)增大,B正确;容器的容积不变,混合气体的质量不变,由ρ=m/v可知,A烧瓶、B烧瓶内气体密度都不变,C正确;放在热水中的A烧瓶内气体颜色变深,放在冰水中的B烧瓶内气体颜色变浅,说明升高温度平衡向生成NO2,降低温度平衡向生成N2O4方向移动,故反应2NO2(g)![]() N2O4(g)的正反应为放热反应,故D错误。
N2O4(g)的正反应为放热反应,故D错误。

练习册系列答案
相关题目