题目内容
3.某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.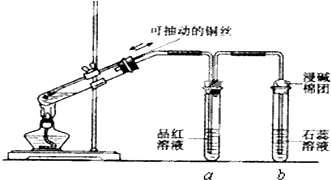
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
(2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用.试管a中的现象是品红溶液褪色,作用是证明二氧化硫具有漂白性.试管b中的现象是紫色石蕊试液变红,作用是证明二氧化硫溶于水显示酸性.
(3)装置中浸碱面团的作用是吸收多余的二氧化硫,防止污染大气.
(4)如图将铜丝改为可抽动的铜丝符合化学实验“绿色化”的原因是通过调节铜丝的高度,可以可知参加反应的铜与浓硫酸的接触面积,从而可知二氧化硫产生的量,减少二氧化硫的污染.
分析 (1)铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;二氧化硫为酸性氧化物,溶于水显示酸性;
(3)二氧化硫有毒,不能直接排放,可以用碱液吸收;
(4)通过调节铜丝的高度,可以控制反应的开始与结束,减少了污染气体的排放、节约了原料.
解答 解:(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式时注意“浓”字,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;
(2)二氧化硫具有漂白性,能够使品红溶液褪色,所以试管a中品红溶液褪色,目的是证明二氧化硫具有漂白性;二氧化硫属于酸性氧化物,溶于水后溶液显示酸性,能够使紫色的石蕊试液变红,
故答案为:品红溶液褪色;证明二氧化硫具有漂白性;紫色石蕊试液变红;证明二氧化硫溶于水显示酸性;
(3)二氧化硫是一种有毒气体,多余的二氧化硫不能直接排放到空气中,应该用碱液吸收,
故答案为:吸收多余的二氧化硫,防止污染大气;
(4)将铜丝改为可抽动的铜丝后,通过调节铜丝的高度,可以可知参加反应的铜与浓硫酸的接触面积,从而可知二氧化硫产生的量,减少二氧化硫的污染,该方法符合绿色化学的理念,
故答案为:通过调节铜丝的高度,可以可知参加反应的铜与浓硫酸的接触面积,从而可知二氧化硫产生的量,减少二氧化硫的污染.
点评 本题考查了浓硫酸的性质、二氧化硫的性质及检验,题目难度中等,注意掌握铜与浓硫酸反应原理、二氧化硫气体的性质及检验方法,明确性质实验方案设计与评价的原则.

| A. | 原子半径:Y<Z<W | |
| B. | 单质的还原性:Y>Z | |
| C. | 气态氢化物的稳定性:X<W | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
| A. | 都可以与溴发生取代反应 | |
| B. | 都容易发生加成反应 | |
| C. | 乙烯易发生加成反应,苯不能发生加成反应 | |
| D. | 乙烯易被酸性高锰酸钾溶液氧化,而苯不能 |
| A. | 1.2q/p mol | B. | 1.2m/p mol | C. | 0.6q/p mol | D. | 0.3q/p mol |