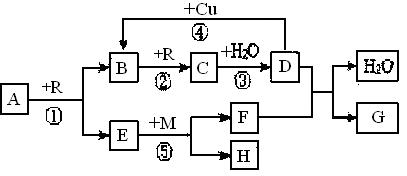
题目内容
短周期主族元素X、Y、Z、W,原子序数依次增大。X、Z同主族,X、Y、Z三种元素原子的最外层电子数之和为15,Y原子最外层电子数等于X原子最外层电子数的一半。下列叙述正确的是
A.非金属性: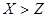 |
B.原子半径: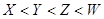 |
C.最高价氧化物对应水化物的酸性: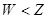 |
| D.单质Y常温下能溶于浓硝酸 |
A
设Y原子最外层电子数为n,则X和Z原子最外层电子数都是2n,则有2n+n+2n=15,解得n=3,因此X是O,Y是Al,Z是S,W是Cl,所以A正确。同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此原子半径大小顺序为Y>Z>W>X,B不正确。非金属性越强,最高价氧化物的水合物的酸性越强,非金属性是Cl>S,因此高氯酸的酸性强于硫酸的,C不正确。常温下铝能和浓硝酸发生钝化,D不正确,答案选A。

练习册系列答案
相关题目
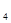 >H
>H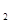 Y0
Y0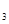 X0
X0