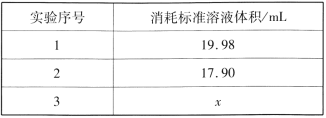
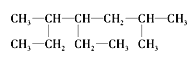题目内容
【题目】I.双氰胺结构简式如图。
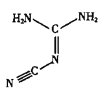
(1)双氰胺的晶体类型为_____。
(2)双氰胺所含元素中,_____(填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_____
II.硼的最简单氢化物——乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH + B2H6 =2LiBH4
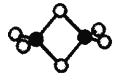
(4)乙硼烷分子中硼原子的杂化轨道类型为______。
(5)BH4-为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为____(填序号)。
A 离子键 B 金属键 C 氢键 D 配位键 E 极性键 F 非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为____(填元素符号)。
Ⅲ.金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
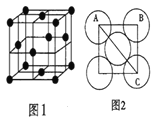
(7)晶体铝中原子的堆积方式为_____。
(8)已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=___g·cm-3(用含a、M、NA的代数式来表示)。
【答案】分子晶体 氮 9:3或3:1 sp3 D、E Li<B<H 面心立方堆积 ![]()
【解析】
(1)根据双氰胺结构简式可知,双氰胺由分子构成;
(2)根据洪特规则分析未成对电子数;
(3)单键全是σ键,双键中有1个σ键、一个π键,叁键中有1个σ键、两个π键;
(4)根据乙硼烷球棍模型可知,乙硼烷分子中1个硼原子形成4个单键;
(5)B、H都是非金属元素的原子, B原子最外层有3个电子;
(6)化合物中电负性强的元素一般显负价;
(7)根据金属铝的晶胞图,顶点、面心各有1个铝原子;
(8)根据![]() =晶胞的摩尔质量÷(1个晶胞的体积×NA)计算;
=晶胞的摩尔质量÷(1个晶胞的体积×NA)计算;
(1)双氰胺由分子构成,属于分子晶体;
(2)根据洪特规则,C、H、N未成对电子数分别2、1、3,未成对电子数最多的元素是氮元素;
(3)单键全是σ键,双键中有1个σ键、一个π键,叁键中有1个σ键、两个π键,根据双氰胺结构简式 可知,σ键和π键数目之比为3:1;
可知,σ键和π键数目之比为3:1;
(4)乙硼烷分子中1个硼原子形成4个单键,所以乙硼烷分子中硼原子的杂化轨道类型为sp3;
(5)B、H都是非金属元素的原子, B原子最外层有3个电子,所以LiBH4中硼原子和氢原子之间形成4个极性共价键,其中有一个是配位键,故选D、E;
(6)电负性强的元素一般显负价,LiBH4中H为-1价,同周期元素从左到右电负性增大,所以电负性从小到大的顺序为Li<B<H;
(7)根据金属铝的晶胞图可知,晶体铝中原子的堆积方式为面心立方堆积;
(8)根据均摊原则,晶胞中铝原子数是![]() ,所以晶胞的摩尔质量是4×Mg/mol;铝原子半径为a cm,则边长为
,所以晶胞的摩尔质量是4×Mg/mol;铝原子半径为a cm,则边长为![]() cm,晶胞体积为
cm,晶胞体积为![]() ,晶胞密度为(4×M)÷(
,晶胞密度为(4×M)÷(![]() ×NA)=
×NA)=![]() g·cm-3。
g·cm-3。

 名校课堂系列答案
名校课堂系列答案【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
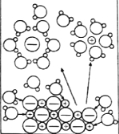
NaCl溶于水 |
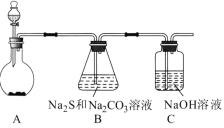
电解CuCl2溶液 |
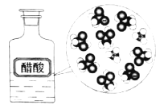
CH3COOH在水中电离 |
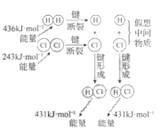
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D