题目内容
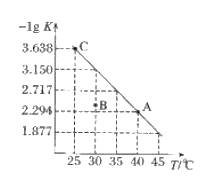
【题目】已知:锂硫电池的总反应为2Li+xS===Li2Sx。以锂硫电池为电源,通过电解含(NH4)2SO4 的废水制备硫酸和化肥的示意图如图 (不考虑其他杂质离子的反应)。下列说法正确的是

A. b为电源的正极
B. 每消耗32 g硫,理论上导线中一定通过2 mol e-
C. SO42-通过阴膜由原料室移向M室
D. N室的电极反应式为2H2O-4e-===O2↑+4H+
【答案】C
【解析】
A. 由图可知M室会生成硫酸,原料室中的SO42-通过阴膜进入M室,所以在M室电极上OH—放电,所以该电极为阳极,因此b极为负极,故A错误;
B. 根据电池的总反应式2Li+xS=Li2Sx,每消耗32x g硫,理论上导线中一定通过2mol e-,故B错误;
C. SO42-为阴离子,阴离子能通过阴膜移向M室,与氢离子结合得到硫酸,故C正确;
D. N室中氢离子放电,所以电极反应为:2H++2e-=H2↑,故D错误。
本题选C。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】下表是元素周期表的一部分,表中序号分别代表某一元素请回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)①-⑩中,最活泼的金属元素是 ______(写元素符号,下同);最不活泼的元素是 ______ ;可作半导体材料的元素是 ______ ;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是______。
(2)④、⑤的简单离子,其半径更大的是 ______ (写离子符号)。
(3)⑧、⑨的气态氢化物,更稳定的是 ______ (填化学式)。
(4)元素的非金属性:① ______ ⑦填“![]() ”或“
”或“![]() ”)。
”)。
(5)①-⑨的最高价氧化物的水化物中:碱性最强的是 ______ (填化学式),酸性最强的是 _________ (填化学式); 盐酸与⑥的最高价氧化物对应的水化物反应的离子方程式为 ______________________________。