题目内容
13.一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4•H2O常用作杀虫剂、媒染剂在碱性镀铜中也常用作电镀液的主要成分,也是高效、安全的广谱杀菌剂,还是植物生长激素,在施药条件下,能促进作物生长,明显提高作物产量.某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为图1: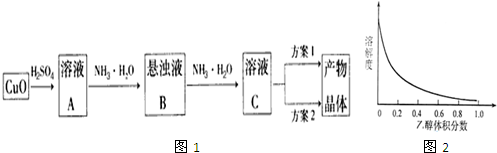
相关信息如下:
①[Cu(NH3)4]SO4•H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4•H2O=[Cu(NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+?Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶.
③[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图2:
请根据信息回答下列问题:
(1)方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
①加热蒸发用到的仪器有:酒精灯、铁架台、坩埚钳、蒸发皿、玻璃棒.
②该方案存在明显缺陷,因为得到的产物晶体中往往含有Cu(OH)2或Cu2(OH)2SO4杂质,产生该杂质的原因是加热蒸发时氨溶解度降低逸出,使[Cu(NH3)4]2+?Cu2++4NH3平衡向右移动产生Cu2+,且Cu2+发生水解.
(2)方案2的实验步骤为:
a.向溶液C中加入浓氨水后,再加入适量乙醇,b.过滤(填操作),c.洗涤,d.干燥
①请在上述内填写合适的试剂或操作名称.
②下列选项中,最适合作为步骤c的洗涤液是C.
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是加热易使[Cu(NH3)4]SO4•H2O分解(失去水或失去氨气).
分析 (1)①根据加热蒸发操作所用的仪器分析判断,加热蒸发需要蒸发皿、酒精灯、玻璃棒等仪器;
②氨气具有挥发性,物质的电离是吸热过程,加热促进使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且铜离子是弱碱离子易水解,所以导致产生杂质;
(2)①根据图象分析,[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的增大而减小,为了减少[Cu(NH3)4]SO4•H2O的损失,应加入乙醇,降低其溶解度,然后过滤得晶体;
②根据图象[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图及实验目的分析;
③含结晶水的晶体加热易失水,不宜采用加热干燥的方法.
解答 解:(1)①蒸发时,需要使用蒸发皿;需要铁架台和铁圈支撑蒸发皿;需要玻璃棒进行搅拌,以防止液体受热不均匀,造成液体飞溅;需要酒精灯进行加热;坩埚钳用于夹持蒸发皿,
故答案为:蒸发皿;玻璃棒;
②该方案存在明显缺陷,因为得到的产物晶体中往往含有Cu(OH)2或Cu2(OH)2SO4杂质,产生该杂质的原因是加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡向右移动,且Cu2+发生水解.
故答案为:Cu(OH)2或Cu2(OH)2SO4;加热蒸发时氨溶解度降低逸出,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解;
(2)①根据Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图知,随着乙醇体积分数的增大,Cu(NH3)4]SO4•H2O的溶解度降低,为了得到Cu(NH3)4]SO4•H2O,应向溶液C中加入适量乙醇,然后进行过滤,
故答案为:乙醇;过滤;
②根据Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图知,随着乙醇体积分数的增大,Cu(NH3)4]SO4•H2O的溶解度降低,为了减少Cu(NH3)4]SO4•H2O的损失,应降低Cu(NH3)4]SO4•H2O的溶解度,所以应选用乙醇和水的混合液;
故答案为:C;
③[Cu(NH3)4]SO4•H2O在加热条件下能分解生成水和氨气,从而得不到纯净的[Cu(NH3)4]SO4 •H2O,所以不宜采用加热干燥的方法,
故答案为:加热易使[Cu(NH3)4]SO4•H2O 分解(失去水或失去氨气).
点评 本题考查一水硫酸四氨合铜合成的方案设计与评价,题目难度中等,注意把握实验操作原理,把握题给信息,掌握实验操作方法,学习中注意积累.

| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠溶液反应的离子方程式Al2O3+2OH-═2AlO2-+H2O.
(4)⑥和⑦分别与氢形成的氢化物中,较稳定的是HCl(填化学式).
(5)元素④与⑥形成的化合物属于离子(填“共价”或“离子”)化合物;用电子式表示其形成过程
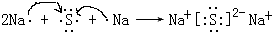 .
.(6)表示①与③形成的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的. 2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8kJ/mol
则氢气的燃烧热为( )
| A. | 438.6 kJ/mol | B. | 241.8 kJ/mol | C. | 285.8kJ/mol | D. | -285.8 kJ/mol |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  | 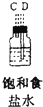 | 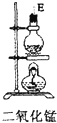 | 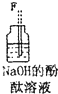 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
 已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )
已知某可逆反应:mA(g)+nB(g)?pC(g)△H=Q kJ•mol-1,在密闭容器中进行,如图表示在不同时间t、温度T和压强P与生成物C的百分含量的关系曲线,下列判断正确的是( )| A. | T1<T2 P1>P2 m+n<P Q<0 | B. | T1>T2 P1<P2 m+n>P Q>0 | ||
| C. | T1<T2 P1<P2 m+n<P Q>0 | D. | T1>T2 P1<P2 m+n>P Q<0 |
| A. | BaSO4?Ba2++SO42- | B. | 2H2O?H3O++OH- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NH3•H2O═NH4++OH- |
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下: