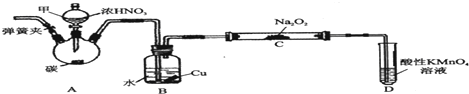
题目内容
8.随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下: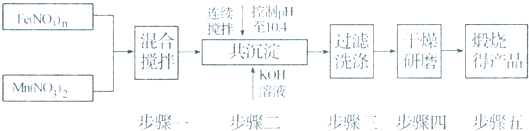
(1)原料Fe(NO3)n中n=3,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为2:1.
(2)步骤二中“连续搅拌”的目的是充分反应、沉淀完全;步骤三中洗涤干净的标准是洗涤至流出液呈中性.
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4$\frac{\underline{\;>1000K\;}}{\;}$MnFe2O4-x+$\frac{x}{2}$O2↑
MnFe2O4+xH2O═MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分比为80%.
②该热化学循环法制氢的优点有(答两点即可)过程简单、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,因此不存在高温气体分离的问题等.
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是寻找合适的催化剂,使MnFe2O4分解温度降低或找分解温度更低的氧化物.
分析 (1)根据MnFe2O4的制备流程,可知Mn、Fe的化合价未变,Mn(NO3)2中Mn的化合价为+2,则MnFe2O4中Fe的化合价为+3,从而求出Fe(NO3)n中的n,
由MnFe2O4中可知:Fe和Mn的个数之比为1:2,根据质量守恒,求出原料Fe(NO3)n和Mn(NO3)2的物质的量之比;
(2)根据搅拌的通常目的和判断沉淀是否洗涤干净的方法来解答;
(3)①根据铁的总价态不变,用方程组来解决;
②从可操作性、环保以及原料的价格等方面分析;
③改进方法可从流程简洁方面考虑.
解答 解:(1)Mn为+2价,则MnFe2O4中Fe的化合价为+3价,则Fe(NO3)n中n=3;
由MnFe2O4中可知:Fe和Mn的个数之比为2:1,所以Fe(NO3)3与Mn(NO3)2 二者的物质的量之比 2:1,
故答案为:3;2:1;
(2)连续搅拌是为了让Fe(NO3)n和Mn(NO3)2充分反应,由于溶液显碱性,则洗涤至洗涤液为中性时,说明沉淀上没有溶液中的离子,即沉淀已经洗涤干净,
故答案为:充分反应、沉淀完全;洗涤至流出液呈中性;
(3)①x=0.8时,铁的总价态为(4-0.8)×2-2=4.4,设1mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为xmol、ymol,则有
$\left\{\begin{array}{l}{x+y=2}\\{2x+3y=4.4}\end{array}\right.$,解得:x=1.6,y=0.4,
则1 mol MnFe2O4-0.8中含Fe2+的物质的量为1.6 mol,则Fe2+占的百分率为$\frac{1.6}{2}$×100%=80%,
故答案为:80%;
②由流程图可以看出过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等,
故答案为:过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等;
③因高温消耗较多的能源,则寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物,
故答案为:寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物.
点评 本题以MnFe2O4的制备为载体,考查学生对工艺流程的理解、对实验操作的理解、化学式有关计算等,难度中等,综合性较强,涉及的知识点多,需要学生具备阅读分析能力和灵活运用知识的解决问题能力.

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案| A. | P、Q、R、S的物质的量浓度之比为:1:1:1:1 | |
| B. | P、Q、R、S在密闭容器中共存 | |
| C. | P、Q、R、S的物质的量浓度不再变化 | |
| D. | v(Q)=v(R) |
| A. | 明矾常作为消毒剂 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 高纯度的硅单质广泛用于制作光导纤维 | |
| D. | 钠的还原性很强,可以用来冶炼金属钛、钽、铌、锆等 |
| A. | 氨水能被弱酸醋酸中和 | |
| B. | 铵盐受热易分解 | |
| C. | 氨水可以使酚酞试液变红 | |
| D. | 0.lmol/L氨水溶液,常温时pH约为11 |
| A. | CaCO3 | B. | Al(OH)3 | C. | Mg(OH)2 | D. | MgCO3 |