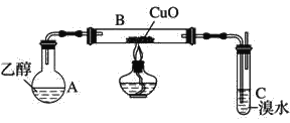
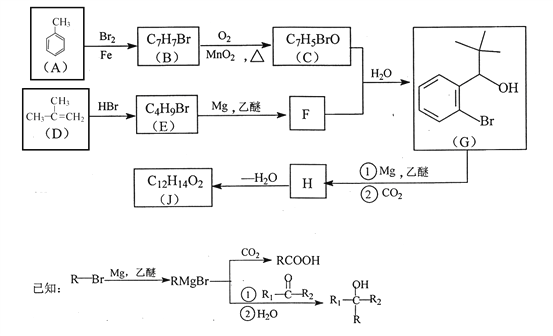
Ő‚ńŅńŕ»›
°ĺŐ‚ńŅ°Ņ Ķ—ť “ī”ļ¨Ķ‚∑Ō“ļ£®ļ¨”–I2°ĘI-Ķ»£©÷–Ľō ’Ķ‚£¨∆š Ķ—ťĻż≥Ő»ÁŌ¬£ļ
ľļ÷™£ļšŚĽĮ ģŃýÕťĽý»żľ◊ĽýÔß «“Ľ÷÷—ŰņŽ◊”ĪŪ√śĽÓ–‘ľŃ£¨Ņ…“‘÷–ļÕ≥ŃĶŪĪŪ√śňýīÝĶńłļĶÁļ…£¨ Ļ≥ŃĶŪŅŇŃ£ŅžňŔĺŘľĮ£¨ŅžňŔŌ¬≥Ń°£Ō¬Ń–ňĶ∑®īŪőůĶń «
A.ļ¨Ķ‚∑Ō“ļ÷– «∑Ůļ¨”–IO3-£¨Ņ…”√KI-ĶŪ∑Ř ‘÷Ĺľž—ť
B.≤Ĺ÷ŤĘŔ÷–Na2S2O3Ņ…”√Na2SO3īķŐś
C.≤Ĺ÷ŤĘŕŅ…“‘”√«„őŲ∑®≥ż»•…Ō≤„«Ś“ļ
D.≤Ĺ÷ŤĘŘ∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™£ļ4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
°ĺīūįł°ŅA
°ĺĹ‚őŲ°Ņ
A. ‘ŕňŠ–‘ŐűľĢŌ¬I-°ĘIO3-°ĘH+ĽŠ∑Ę…ķ—űĽĮĽĻ‘≠∑ī”¶≤ķ…ķI2£¨I2”ŲĶŪ∑Ř»‹“ļĪšő™ņ∂…ę£¨»Ű»‹“ļ≤Ľ «Ō‘ňŠ–‘£¨‘Úőř∑®ľž—ť£¨AīŪőů£Ľ
B. ≤Ĺ÷ŤĘŔ÷– «ņŻ”√Na2S2O3ĶńĽĻ‘≠–‘£¨”…”ŕNa2SO3“≤ĺŖ”–«ŅĶńĽĻ‘≠–‘£¨“Úīň“≤Ņ…”√Na2SO3īķŐśNa2S2O3£¨B’ż»∑£Ľ
C. ”…”ŕCuI «ń—»‹–‘ĻŐŐŚ£¨∆š”ŗőÔ÷ ∂ľ»‹Ĺ‚‘ŕňģ÷–£¨“Úīň≤Ĺ÷ŤĘŕŅ…“‘”√«„őŲ∑®≥ż»•…Ō≤„«Ś“ļ£¨C’ż»∑£Ľ
D. Fe3+ĺŖ”–—űĽĮ–‘£¨ĽŠĹęCuI—űĽĮ≤ķ…ķCu2+°ĘI2£¨Fe3+ĪĽĽĻ‘≠≤ķ…ķFe2+£¨łýĺ›ĶÁ◊” ōļ„°ĘĶÁļ… ōļ„ľį‘≠◊” ōļ„£¨Ņ…Ķ√≤Ĺ÷ŤĘŘ∑Ę…ķ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™£ļ4Fe3++2CuI![]() 4Fe2++2Cu2++I2£¨D’ż»∑£Ľ
4Fe2++2Cu2++I2£¨D’ż»∑£Ľ
Ļ ļŌņŪ—°ŌÓ «A°£

°ĺŐ‚ńŅ°Ņ£®1£©ń≥ĽĮ—ß—–ĺŅ–‘—ßŌį–°◊ťń£ń‚Ļ§“ĶļŌ≥…įĪĶń∑ī”¶°£‘ŕ»›ĽżĻŐ∂®ő™2LĶń√‹Ī’»›∆ųńŕ≥š»Ž1molN2ļÕ3mol H2£¨ľ”»ŽļŌ īŖĽĮľŃ(ŐŚĽżŅ…“‘ļŲ¬‘≤Ľľ∆)ļů‘ŕ“Ľ∂®ő¬∂»—Ļ«ŅŌ¬Ņ™ ľ∑ī”¶£¨≤Ę”√—ĻѶľ∆ľŗ≤‚»›∆ųńŕ—Ļ«ŅĶńĪšĽĮ»ÁŌ¬£ļ
∑ī”¶ Īľš /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
—Ļ«Ņ /MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
‘Úī”∑ī”¶Ņ™ ľĶĹ25 min Ī£¨“‘N2ĪŪ ĺĶń∆Ĺĺý∑ī”¶ňŔ¬ £Ĺ____£Ľ
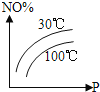
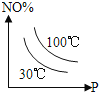
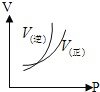
£®2£©Ļ§“ĶļŌ≥…įĪĶń∑ī”¶∑Ĺ≥Ő Ĺő™£ļN2(g)+3H2(g)![]() 2NH3(g) ¶§H°£»ÁÕľ1 «ļŌ≥…įĪ∑ī”¶Ķńń‹ŃŅ”Ž∑ī”¶Ļż≥ŐŌŗĻōÕľ£®őī Ļ”√īŖĽĮľŃ£©£ĽÕľ2 «ļŌ≥…įĪ∑ī”¶‘ŕ2L»›∆ų÷–°ĘŌŗÕ¨Õ∂ŃŌ«ťŅŲŌ¬°Ę∆šňŁŐűľĢ∂ľ≤ĽĪš Ī£¨ń≥“Ľ∑ī”¶ŐűľĢĶńłńĪš∂‘∑ī”¶Ķń”įŌžÕľ°£
2NH3(g) ¶§H°£»ÁÕľ1 «ļŌ≥…įĪ∑ī”¶Ķńń‹ŃŅ”Ž∑ī”¶Ļż≥ŐŌŗĻōÕľ£®őī Ļ”√īŖĽĮľŃ£©£ĽÕľ2 «ļŌ≥…įĪ∑ī”¶‘ŕ2L»›∆ų÷–°ĘŌŗÕ¨Õ∂ŃŌ«ťŅŲŌ¬°Ę∆šňŁŐűľĢ∂ľ≤ĽĪš Ī£¨ń≥“Ľ∑ī”¶ŐűľĢĶńłńĪš∂‘∑ī”¶Ķń”įŌžÕľ°£

Ō¬Ń–ňĶ∑®’ż»∑Ķń «£®_____£©
A.¶§H=-92.4kJ/mol
B. Ļ”√īŖĽĮľŃĽŠ ĻE1Ķń ż÷Ķ‘Ųīů
C.ő™ŃňŐŠłŖ◊™ĽĮ¬ £¨Ļ§“Ķ…ķ≤ķ÷–∑ī”¶Ķńő¬∂»‘ĹĶÕ‘Ĺļ√
D.ÕľĘÚ «≤ĽÕ¨—Ļ«ŅŌ¬∑ī”¶ŐŚŌĶ÷–įĪĶńőÔ÷ ĶńŃŅ”Ž∑ī”¶ ĪľšĻōŌĶÕľ£¨«“PA<PB
E.ÕľĘÚ «≤ĽÕ¨ő¬∂»Ō¬∑ī”¶ŐŚŌĶ÷–įĪĶńőÔ÷ ĶńŃŅ”Ž∑ī”¶ ĪľšĻōŌĶÕľ£¨«“TA>TB
F.ł√∑ī”¶Ķń∆Ĺļ‚≥£ żKA<KB
G.‘ŕ«ķŌŖAŐűľĢŌ¬£¨∑ī”¶ī”Ņ™ ľĶĹ∆Ĺļ‚£¨ŌŻļńN2Ķń∆ĹĺýňŔ¬ ő™n1/(4t1) mol/(L.min)
£®3£©“Ľ∂®ő¬∂»Ō¬£¨ŌÚ“ĽłŲ»›Ľżő™2LĶń√‹Ī’»›∆ų÷–Õ®»Ž2molN2ļÕ7molH2£¨īÔĶĹ∆Ĺļ‚ Ī≤‚Ķ√»›∆ųńŕĶń—Ļ«Ņő™∆ū ľ ĪĶń7/9Ī∂£¨‘Úīňő¬∂»Ō¬Ķń∆Ĺļ‚≥£ żő™___°£‘ŕÕ¨“Ľő¬∂»£¨Õ¨“Ľ»›∆ų÷–£¨Ĺę∆ū ľőÔ÷ łńő™amolN2£¨bmolH2ļÕcmolNH3£®a°Ęb°Ęcĺý≤Ľő™Ń„£©”Ż Ļ∆Ĺļ‚ĽžļŌőÔ÷–łųőÔ÷ Ķń÷ ŃŅ”Ž‘≠∆Ĺļ‚ŌŗÕ¨£¨‘Úa°Ęb°Ęc¬ķ◊„ĶńĻōŌĶő™____£®”√ļ¨a°Ęb°ĘcĶńĪŪīÔ ĹĪŪ ĺ£©£¨«“”Ż Ļ∑ī”¶‘ŕ∆ū ľ ĪŌÚńś∑ī”¶∑ĹŌÚĹÝ––£¨cĶń»°÷Ķ∑∂őß «____°£
°ĺŐ‚ńŅ°ŅŌ¬Ń– Ķ—ť≤Ľń‹īÔĶĹ Ķ—ťńŅĶńĶń «
A | B | C | D | |
Ķ—ť |
|
|
|
|
Ķ—ťńŅĶń | Ķ—ť “÷∆»°įĪ∆Ý | ÷§√ų““»≤Ņ… ĻšŚňģÕ …ę | ľž—ť’ŠŐ«ĶńňģĹ‚≤ķőÔĺŖ”–ĽĻ‘≠–‘ | ÷§√ų»‹Ĺ‚∂»£ļ |
A.AB.BC.CD.D