题目内容
【题目】(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强 /MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min时,以N2表示的平均反应速率=____;
(2)工业合成氨的反应方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH。如图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
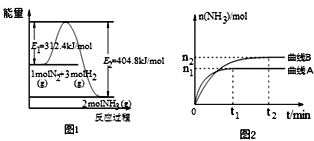
下列说法正确的是(_____)
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的温度越低越好
D.图Ⅱ是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB
E.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB
F.该反应的平衡常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为n1/(4t1) mol/(L.min)
(3)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,达到平衡时测得容器内的压强为起始时的7/9倍,则此温度下的平衡常数为___。在同一温度,同一容器中,将起始物质改为amolN2,bmolH2和cmolNH3(a、b、c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a、b、c满足的关系为____(用含a、b、c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是____。
【答案】0.01mol·L-1·min-1 AEFG 0.25L2/mol2 a+c/2=2,b+3c/2=7 2<c<4
【解析】
(1)同一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,
16.80:12.60=(1+3)mol:x,x=![]() =3,所以平衡时混合气体的物质的量为3mol,设参加反应的氮气的物质的量为y,则
=3,所以平衡时混合气体的物质的量为3mol,设参加反应的氮气的物质的量为y,则
N2(g)+3H2(g)![]() 2NH3(g) 物质的量减少
2NH3(g) 物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol
解得y=0.5mol;
则从反应开始到25min时,以N2表示的平均反应速率=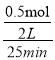 =0.01mol/(L·min);
=0.01mol/(L·min);
(2)A.依据图象分析,反应焓变△H=312.4kJ/mol-404.8kJ/mol=-92.4kJ/mol,选项A正确;
B.使用催化剂改变反应速率降低反应的活化能,E1减小,选项B错误;
C.为了提高转化率,反应是放热反应,温度越低平衡正向进行,工业生产中反应速率慢,生成效率和经济效益低,选项C错误;
D.图2是不同压强下反应体系中氨的物质的量与反应时间关系,依据先拐先平压强大,pA>pB ,压强越大氨气物质的量增大,选项D错误;
E.图2是不同温度下反应体系中氨的物质的量与反应时间关系先拐先平温度高,TA>TB,选项E正确;
F.反应的平衡常数随温度变化,该反应温度不变,平衡常数不变,压强改变不影响平衡常数,图象中影响因素依据DE分析是温度改变,TA>TB,温度越高平衡逆向进行,平衡常数KA<KB,选项F正确;
G.在曲线A条件下,反应从开始到平衡,V(NH3)=![]() =
=![]() mol/Lmin,反应速率之比等于系数之比,消耗N2的平均速率=
mol/Lmin,反应速率之比等于系数之比,消耗N2的平均速率=![]() V(NH3)=
V(NH3)=![]() mol/Lmin,选项G正确;
mol/Lmin,选项G正确;
答案选AEFG;
(3)一定温度下,向一个容积为2L的密闭容器中通入2molN2和7molH2,则依据平衡三段式列式计算,设氮气消耗物质的量为x;
N2(g)+3H2(g)![]() 2NH3(g),
2NH3(g),
起始量(mol) 2 7 0
变化量(mol) x 3x 2x
平衡量(mol) 2-x 7-3x 2x
达到平衡时测得容器内的压强为起始时的倍,气体物质的量之比等于压强之比;2-x+7-3x+2x=(2+7)
x=1
平衡常数K=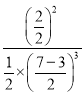 =0.25 L2/mol2;
=0.25 L2/mol2;
对于恒温恒容下对于反应前后气体体积发生变化的反应来说(即O n≠0的体系) :等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同即可,据此可知欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为a+0.5c=2、b+1.5c=7;
由于平衡时氨气的物质的量是2mol,所以要欲使反应在起始时向逆反应方向进行,c的取值范围是c>2。当起始时反应物的物质的量为0时,氨气的物质的量最大,所以根据a+0.5c=2、b+1.5c=7可知,c=4或4.7,因此c的取值范围是2<c<4。

【题目】2019年10月27日,国际清洁能源会议(ICCE2019)在北京开幕。一碳化学成为这次会议的重要议程。甲醇、甲醛(HCHO) 等一碳化合物在化工 、医药,能源等方面都有着广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),反应生成 1mol HCHO过程中能量变化如图1。
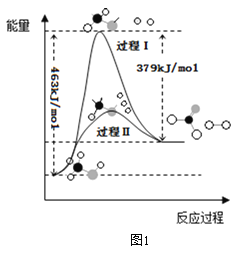
已知:CO2(g)+3H2(g)=CH3OH(g) +H2O(g) △H=-49.5kJ mo1-1,则反应CO2(g)+2H2(g)= HCHO(g) +H2O(g) △H= ___________kJ mo1-1。
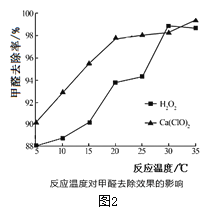
(2)氧化剂可处理甲醛污染,结合图2分析春季(水温约为15℃)应急处理被甲醛污染的水源应选择的试剂为__________(填化学式)。
(3)纳米二氧化钛催化剂可用于工业上合成甲醇,CO2(g)+2H2(g)![]() CH3OH(g) △H=akJmo1-1
CH3OH(g) △H=akJmo1-1
①按![]() =2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。
=2,投料比将H2与CO充入VL恒容密闭容器中,在一定条件下发生反应测定CO的平衡转化率与温度、压强的关系如图3所示。则a _____(填“>”或“<”)0;压强p1、p2、p3由小到大的关系是__________________。
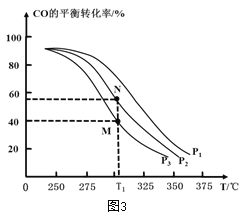
②在温度为T1℃,向某恒容密闭容器中充入 H2和CO发生上述反应,起始时c(H2)=c(CO)=2.0 mo1L-1。达到平衡时,CO的转化率为图3中的 M 点对应的转化率,则在该温度下,对应的N 点的平衡常数为__________(保留3 位有效数字)。
(4)工业上利用CH4(CO和H2)与水蒸气在一定条件下制取 H2:CH4(g) +H2O(g)![]() CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO(g)+3H2(g) △H=+203kJmo1-1,该中反应的逆反应速率及表达式为v逆=kc(CO)c3(H2),k 为速率常数,在某温度下测得实验数据如表所示,
CO浓度(mo1L-1) | H2浓度(mo1L-1) | 逆反应速率(mo1L-1min-1) |
0.1 | c1 | 8.0 |
c2 | c1 | 16.0 |
c2 | 0.15 | 6.75 |
由上还数据可得该温度下,c2=____________,该反应的逆反应速率常数 k=______L3mo1-3min-1)。