题目内容
16.已知W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z同周期,W、Z同主族,其中X、Y为金属元素,W与Y的原子序数相差5,下列说法正确的是( )| A. | X离子的氧化性大于Y离子 | B. | W的气态氢化物的稳定性比Z的弱 | ||
| C. | 含Y的盐溶液一定显酸性 | D. | X离子的半径小于W离子 |
分析 W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z同周期,W、Z同主族,则W处于第二周期,X、Y、Z处于第三周期,而X、Y为金属元素,则金属性X>Y,W、Z为非金属,且非金属性W>Z,
A.金属性越强,阳离子氧化性越弱;
B.非金属性越强,其氢化物越稳定性;
C.Y可能为Mg或Al,偏铝酸钠溶液呈碱性;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答 解:W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z同周期,W、Z同主族,则W处于第二周期,X、Y、Z处于第三周期,而X、Y为金属元素,则金属性X>Y,W、Z为非金属,且非金属性W>Z.
A.金属性X>Y,金属性越强,阳离子氧化性越弱,即X离子的氧化性小于Y离子,故A错误;
B.非金属性W>Z,非金属性越强,其氢化物越稳定性,即W的气态氢化物的稳定性比Z的强,故B错误;
C.Y可能为Mg或Al,而偏铝酸钠溶液呈碱性,故C错误;
D.X离子、W离子核外电子层结构相同,X离子核电荷数较大,其离子半径较小,故D正确,
故选D.
点评 本题考查位置结构性质关系综合应用,关键是明确元素的相对位置,C选项为易错点,学生容易忽略偏铝酸盐,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.如果定义有机物的同系列是一系列结构式符合A[W]nB(其中n=0,1,2,3…的化合物.式中A、B是任意一种基团(或氢原子),W为2价有机基团,又称为该同系列的系差,同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
| A. | CH3CH2CH2CH3、CH3CH2CH2CH2CH3、CH3CH2CH2CH2CH2CH3 | |
| B. | CH3CH=CHCHO、CH3CH=CHCH=CHCHO、CH3(CH=CH)3CHO | |
| C. | CH3CH2CH3、CH3CHClCH2CH3、CH3CHClCH2CHClCH3 | |
| D. | ClCH2CHClCCl3、ClCH2CHClCH2CHClCCl3、ClCH2CHClCH2CHClCH2CHClCCl3 |
11.X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2X04和HY04.R、M同主族,R与冷水即可反应,M与热水反应缓慢.下列关系正确的是( )
| A. | 原子半径X>Y | B. | 氢化物稳定性H2X>HY | ||
| C. | 原子核内质子数R<M | D. | 溶液碱性ROH<MOH |
1.化学与环境、生活、材料密切相关,下列说法正确的是( )
| A. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 气溶胶和液溶胶的差别在于分散质的物质状态 |
8.一定温度下,对于可逆反应N2O4(g)?2NO2(g)△H>0,在密闭容器中达到平衡状态.下列有关说法中正确的是( )
| A. | 保持温度不变,缩小容器的体积,平衡向逆反应方向移动,再次达到平衡时气体的颜色变浅了 | |
| B. | 若保持恒温恒压,再充入一定量的NO2气体,当容器的体积不再变化时表明重新达到平衡状态 | |
| C. | 保持容器的体积不变,升高温度,正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| D. | 恒温恒容条件下,再充入一定量的N2O4,达到新平衡时NO2的体积分数比原平衡的大 |
5.-种物质的化学式为NH5其所有构成原子的最外层都符合相应稀有气体原子的最外电子层结构,下列有关该物质的说法中,正确的是( )
| A. | NH5的熔沸点低于N3的熔沸点 | |
| B. | NH5中N元素显+5价 | |
| C. | NH5固体投人稀盐酸中,会生成氨气和氩气 | |
| D. | NH5中滴人少量的水时会剧烈反应,该反应的化学方程式可表示为山NH5═NH3↑+H2↑ |
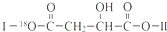 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.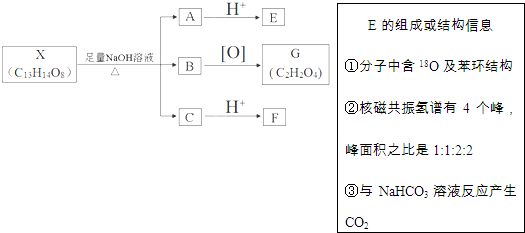
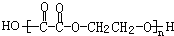 +(2n-1)H2O
+(2n-1)H2O +4NaOH$→_{△}^{水}$
+4NaOH$→_{△}^{水}$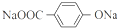 +NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O
+NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O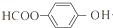 等
等 ;反应类型:取代反应
;反应类型:取代反应 ;反应类型:加聚反应
;反应类型:加聚反应