题目内容
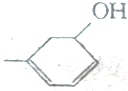
5.-种物质的化学式为NH5其所有构成原子的最外层都符合相应稀有气体原子的最外电子层结构,下列有关该物质的说法中,正确的是( )| A. | NH5的熔沸点低于N3的熔沸点 | |
| B. | NH5中N元素显+5价 | |
| C. | NH5固体投人稀盐酸中,会生成氨气和氩气 | |
| D. | NH5中滴人少量的水时会剧烈反应,该反应的化学方程式可表示为山NH5═NH3↑+H2↑ |
分析 -种物质的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,应为NH4H,是一种离子化合物,能与水反应:NH4H+H2O=NH3•H2O+H2↑,因为该反应放热,所以有氨气放出,据此分析解答.
解答 解:A.NH4H是一种离子化合物,N3是一种分子晶体,所以NH4H熔、沸点高于N3,故A错误;
B.NH4H是一种离子化合物,N元素显-3价,故B错误;
C.能与水反应:NH4H+H2O=NH3•H2O+H2↑,所以投人稀盐酸中,会反应生成氯化铵和氢气,故C错误;
D.NH4H是一种离子化合物,能与水反应放热使氨气放出,所以化学方程式可表示为山NH5═NH3↑+H2↑,故D正确.
故选D.
点评 本题考查NH5的组成和性质,题目难度不大,解答本题的关键是把握题给信息.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.已知W、X、Y、Z为原子序数依次增大的短周期主族元素,X、Y、Z同周期,W、Z同主族,其中X、Y为金属元素,W与Y的原子序数相差5,下列说法正确的是( )
| A. | X离子的氧化性大于Y离子 | B. | W的气态氢化物的稳定性比Z的弱 | ||
| C. | 含Y的盐溶液一定显酸性 | D. | X离子的半径小于W离子 |
10.-种新型试剂常用于氧化降解溶液中的有机污染物(用X表 示),在一定条件下反应开始时其浓度为2.0×10-3mol•L-1,反应10 min后进行测定,测得数据如图1、图2所示,则下列有关说法正确的是( )


| A. | pH=2、温度为50℃、10 min时,X的物质的量浓度c( X)为5.6×10-4mol•L-1 | |
| B. | 图2说明:任何条件下X降解率均随温度升高先增后减 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | 图1说明:50℃时,X的降解率随溶液PH的增大而逐渐减小 |
2.浓硫酸是一种重要的化工产品.某化学兴趣小组拟探究Cu与浓H2SO4的反应.
Ⅰ.[查阅资料]
铜与浓硫酸反应产生黑色物质的相关性质资料如下表:
Ⅱ.[探究过程]

(1)试管A中发生的反应的主要化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)反应进行一段时间可观察到试管B中的现象为溶液由红色变成无色.
(3)试管C浸有NaOH溶液的棉团与试管E的NaOH溶液的作用是否相同相同(填“相同或不相同”)
(4)如同时将试管B换成试管D,将试管C换成试管E,并从试管D的直立导管中通入另一种气体,试管D中产生白色沉淀,则气体可以是NH3(NO2或ClO2)、Cl2(O3或O2或Br2蒸汽)(填一种化合物和一种单质的化学式);试管E中CCl4的作用是防倒吸.
(5)用简单方法证明A试管中反应所得产物含有铜离子的操作方法是(停止反应,冷却后),取A中溶液少许于一盛有少量水的烧杯(试管)里,摇匀,观察溶液颜色呈蓝色;分离出试管E中的上层液体,其分离的操作名称为分液.
Ⅲ.[问题反思]
(6)仅由上述资料及探究过程可得出的正确结论是abd.
a.铜与浓硫酸作用所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免产物中出现黑色物质
c.反应发生条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现,越难消失.
Ⅰ.[查阅资料]
铜与浓硫酸反应产生黑色物质的相关性质资料如下表:
| 资料1 | 硫酸浓度mol/L | 黑色物质出现的温度∕℃ | 黑色物质消失的温度∕℃ |
| 15 | 约150 | 约236 | |
| 16 | 约140 | 约250 | |
| 18 | 约120 | 不消失 | |
| 资料2 | X射线衍射晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. | ||

(1)试管A中发生的反应的主要化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)反应进行一段时间可观察到试管B中的现象为溶液由红色变成无色.
(3)试管C浸有NaOH溶液的棉团与试管E的NaOH溶液的作用是否相同相同(填“相同或不相同”)
(4)如同时将试管B换成试管D,将试管C换成试管E,并从试管D的直立导管中通入另一种气体,试管D中产生白色沉淀,则气体可以是NH3(NO2或ClO2)、Cl2(O3或O2或Br2蒸汽)(填一种化合物和一种单质的化学式);试管E中CCl4的作用是防倒吸.
(5)用简单方法证明A试管中反应所得产物含有铜离子的操作方法是(停止反应,冷却后),取A中溶液少许于一盛有少量水的烧杯(试管)里,摇匀,观察溶液颜色呈蓝色;分离出试管E中的上层液体,其分离的操作名称为分液.
Ⅲ.[问题反思]
(6)仅由上述资料及探究过程可得出的正确结论是abd.
a.铜与浓硫酸作用所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免产物中出现黑色物质
c.反应发生条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现,越难消失.
19.磷酸铁锂电池结构如图所示,左边是磷酸铁锂电池材料为电池的正极,有铝箔与电池一极连接;中间是聚合物隔膜,锂离子可以通过而电子不能通过;右边由石墨组成,铜箔与电池另一极连接,电池内充满电解质.在充电过程中,LiFePO4中的锂离子脱出并伴随着铁元素的氧化,下列说法不正确的是( )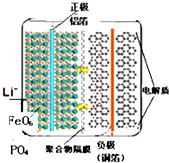

| A. | 放电时,铝箔所在电极为负极,铜箔所在电极为正极 | |
| B. | 放电时,电池反应式为:FePO4+Li═LiFePO4 | |
| C. | 充电时,Li+向阴极移动 | |
| D. | 充电时,阳极的电极反应式为:LiFePO4-e-═FePO4+Li+ |
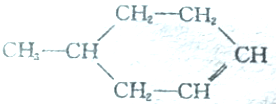 可以写成
可以写成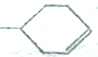 ,现有有机物A,可写为
,现有有机物A,可写为