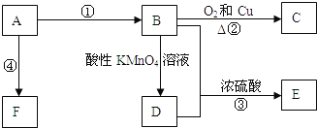
题目内容
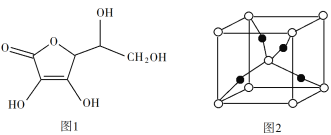
【题目】(1)用系统命名法命名: ![]() ____________________________________。
____________________________________。
(2)2,6-二甲基-4-乙基辛烷的结构简式是_______________________,1 mol该烃完全燃烧需消耗氧气____mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为______。
②碳碳间共用电子对数为n的单烯烃的分子式为______。
【答案】3,4-二甲基辛烷 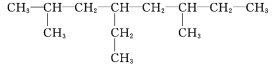 18.5 n-1 CnH2n
18.5 n-1 CnH2n
【解析】
(1)烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
(2)根据烷烃的命名原则写出该有机物的结构简式;根据该有机物的结构简式写出分子式,然后计算出完全燃烧消耗的氧气的物质的量;
(3)每个碳原子有4个价键,对于烃CxHy分子,除了氢原子之外就是碳与碳之间的共用电子对,由于每两个碳共用这些电子对,因此碳与碳之间的共用电子对数为4x-y/2,利用此公式代入即可求解本题。
(1)![]() 该有机物最长碳链8个C,主链为辛烷,编号从左下方开始,该有机物命名为: 3,4-二甲基辛烷,故答案为:3,4-二甲基辛烷。
该有机物最长碳链8个C,主链为辛烷,编号从左下方开始,该有机物命名为: 3,4-二甲基辛烷,故答案为:3,4-二甲基辛烷。
(2)2,6-二甲基-4-乙基辛烷,主链为辛烷,在2、6号C各含有1个甲基,在4号C含有1个乙基,该有机物结构简式为: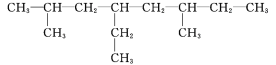 ,根据其结构简式可知该有机物分子式为:C12H26,1mol该有机物完全燃烧消耗的氧气的物质的量为:(12+26/4)mol=18.5mol,故答案为:
,根据其结构简式可知该有机物分子式为:C12H26,1mol该有机物完全燃烧消耗的氧气的物质的量为:(12+26/4)mol=18.5mol,故答案为: ;18.5。
;18.5。
(3)①每个碳原子形成4个共价键,对于烃分子CxHy,除了碳与氢之间的共用电子对之外就是碳与碳之间的共用电子对,CnH2n+2是烷烃的通式,相邻两个碳原子之间都有1对共用电子,n个碳原子间应有(n-1)对共用电子,故答案为:n-1。
②单烯烃相邻两个碳原子之间都有2对共用电子,单烯烃比相应烷烃少了2个氢原子,烷烃通式为:CnH2n+2,所以单烯烃通式为:CnH2n;故答案为:CnH2n。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】某研究小组探究氨基甲酸铵(NH2COONH4)分解的化学平衡和水解反应速率。
(1)将一定量纯净的氨基甲酸铵置于固定容积为 100mL 的密闭真空溶液 A 中,在恒定温度下使其达到分解 平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g),若 25.0℃时达到平衡所用时间为8min,根据数据计算 NH3 的平均生成速率为__________。
②可以判断该分解反应已经达到化学平衡的是_____。
A. 2v(NH3)正=v(CO2)逆
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵 溶液测定水解反应速率,得到 c(NH2COO-)随时间变化趋势如图所示。根据图中信息,如何说明水解反应速率随温度升高而增大:_____。

(3)合成氨工业对国民经济和社会发展具有重要意义。工业合成氨常用的催化剂是_____,氨分子的电子式是_____。
(4)如图是一定的温度和压强下时 N2 和 H2 反应生成 1molNH3 过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:__________________________。(热量 Q 的数值使用含字母 a、b 的代数式表示)

(5)在催化剂存在下,NH3 可用来消除 NO 的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是_______________。
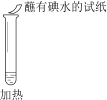
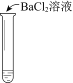
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化