题目内容
【题目】用钒钛磁铁为原料冶炼铁,产生一种固体废料,主要成分如下表。
物质 | TiO2 | MgO | SiO2 | CaO | Al2O3 |
质量百分含量/% | 51.00 | 12.52 | 5.39 | 4.00 | 19.34 |
通过下列工艺流程可以实现元素Ti、Al、 Si的回收利用,并得到纳米二氧化钛和分子筛。

请回答下列问题:
(1)步骤①②③中进行分离操作的名称是_____________________。
(2)下列固体废料的成分中,不属于碱性氧化物的是___________________(填字母序号)。
a.TiO2 b.MgO c.SiO2 d.CaO
(3)熔融温度和钛的提取率关系如下图,适宜温度为500℃,理由__________________。

(4)滤液①中溶质的成分是_______________________。
(5)步骤②中发生反应的离子方程式是___________________________。
(6)将步骤③中制取分子筛的化学方程式补充完整:_______
□____+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+□
根据成分表中数据,计算10kg固体废料,理论上应再加入Na2SiO3物质的量的计算式是n(Na2SiO3)=______mol (摩尔质量/g/mol:SiO2 60 Al2O3 102)。
【答案】 过滤 a、c 400℃钛的提取率太低,600℃钛的提取率提高不多,从节约能源,降低生产成本角度考虑,500℃最适宜 NaAlO2、Na2SiO3、NaOH Na2TiO3+2H+=H2TiO3+2Na+ 6NaAlO2 10NaOH ![]()
【解析】(1)根据流程图可知,步骤①②③操作后都得到滤渣和滤液,因此操作的名称是过滤。正确答案:过滤。
2) 碱性氧化物是指与酸反应生成盐和水,题中TiO2 和SiO2一般不与酸反应,不属于碱性氧化物;正确选项a、c。
(3)从图像可以看出400℃,钛的提取率太低,600℃钛的提取率提高不多,从节约能源、降低生产成本角度考虑,500℃最适宜;正确答案:400℃钛的提取率太低,600℃钛的提取率提高不多,从节约能源,降低生产成本角度考虑,500℃最适宜。
(4)二氧化硅和氧化铝与过量的氢氧化钠反应生成的产物分别为硅酸钠和偏铝酸钠,因此滤液①中溶质的成分是:NaAlO2、Na2SiO3、NaOH;正确答案:NaAlO2、Na2SiO3、NaOH。
(5) 步骤②是由于加入了稀盐酸使NaTiO3转化为H2TiO3,NaTiO3为固体,所以利用强酸制备弱酸规律,该反应的离子方程式:Na2TiO3+2H+=H2TiO3+2Na+ ;正确答案:Na2TiO3+2H+=H2TiO3+2Na+。
6)根据元素守恒配平,所缺的物质为6NaAlO2、10NaOH;根据反应可知:上一问的方程式硅酸钠与偏铝酸钠的比为1;1,根据图表的数据,偏铝酸钠的物质的量为(2×10000×19.34%)/102mol,硅酸钠的物质的量为(10000×5.39%)/60mol,所以需要加入的硅酸钠的物质的量为两者的差值:100×([2×19.31/102]-[5.39/60]);正确答案:6NaAlO2、10NaOH;100×([2×19.31/102]-[5.39/60])。

 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】某化工厂的含镍催化剂主要含有镍、铝、铁单质及它们的氧化物,还有部分不溶于酸和碱的杂质。为了从含镍催化剂中回收镍,设计了如下的工艺流程:
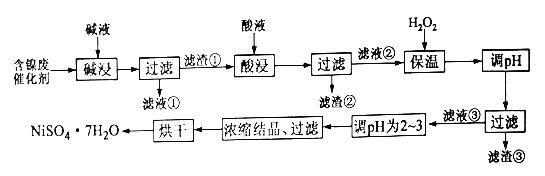
部分阳离子完全沉淀时溶液的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答如下问题:
(1)碱浸的目的是为了除去____________
(2)某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作_________
(3)加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为______,加入H2O2发生反应的离子方程式为___________。加入H2O2保温后调pH,下列范围合理的是______(填选项序号)。
A.1.8~3.2 B.2.0~3.0 C.3.3~5.2 D.9.2~9.7
(4)滤渣③的主要成分为_______,滤液③调pH为2~3的目的为________
(5)为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为____________________


