题目内容
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
【答案】B
【解析】试题分析:A、H2A是弱电解质,H2A在水中的电离方程式是:H2AH++HA-、HA-H++A2-,故A错误;B、当V(NaOH)="20" mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;C、由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,故C错误;D、当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)+c(HA-)+3c(H2A)═c(A2-)+2c(OH-),故D错误;故选B。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案【题目】某化工厂的含镍催化剂主要含有镍、铝、铁单质及它们的氧化物,还有部分不溶于酸和碱的杂质。为了从含镍催化剂中回收镍,设计了如下的工艺流程:
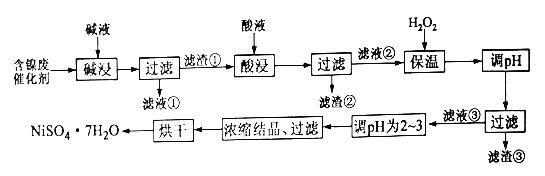
部分阳离子完全沉淀时溶液的pH如下:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答如下问题:
(1)碱浸的目的是为了除去____________
(2)某学习小组在实验室中模拟上述流程,简述洗涤滤渣①的操作_________
(3)加入H2O2并保温一段时间过程中,保温的温度不宜过高的原因为______,加入H2O2发生反应的离子方程式为___________。加入H2O2保温后调pH,下列范围合理的是______(填选项序号)。
A.1.8~3.2 B.2.0~3.0 C.3.3~5.2 D.9.2~9.7
(4)滤渣③的主要成分为_______,滤液③调pH为2~3的目的为________
(5)为测定产品中NiSO4·7H2O纯度,某同学将一定量的样品溶于水,再向其中加入足量的BaCl2溶液,过滤、洗涤沉淀并干燥,称量质量。通过计算发现产品中NiSO4·7H2O的质量分数大于100%,其可能的原因为____________________