题目内容
【题目】下列说法或表示方法正确的是( )
A. 在稀溶液中,H2SO4和Ba(OH)2的中和热要大于57.3kJ/mol
B. 2C(s)+O2(g)═2CO(g)△H <O,△S>O
C. 已知:2SO2(g) +O2(g)![]() 2SO3 (g) ;△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3 (g) ;△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
D. 在10lkPa、25℃时,1gH2完全燃烧生成气态水,放出120.9kJ的热量,则氢气的燃烧热为241.8 kJ/mol
【答案】B
【解析】
A. 在稀溶液中,强酸跟强碱发生中和反应生成1 mol水时的反应热叫做中和热,在稀溶液中,H2SO4和Ba(OH)2的中和热等于57.3kJ/mol,故A错误;
B. 2C(s)+O2(g)═2CO(g)燃烧过程均为放热反应,△H <O;该反应是气体体积增加的反应,即为混乱度增大的过程,△S>O;故B正确
C. 已知:2SO2(g) +O2(g)![]() 2SO3 (g) ;△H=-98.3kJ/mol。该反应为可逆反应,△H=-98.3kJ/mol为反应进行彻底时放出的热量,将1molSO2和0.5molO2充入一密闭容器中反应,放出的热量小于49.15kJ,故C错误。
2SO3 (g) ;△H=-98.3kJ/mol。该反应为可逆反应,△H=-98.3kJ/mol为反应进行彻底时放出的热量,将1molSO2和0.5molO2充入一密闭容器中反应,放出的热量小于49.15kJ,故C错误。
D. 在10lkPa、25℃时,1gH2完全燃烧生成气态水,水蒸气不是稳定的氧化物,不能用于计算燃烧热,故D错误;
答案选B

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】(1)在2L密闭容器中,起始投入4 molN2和6molH2在一定条件下生成NH3,平衡时仅改变温度测得的数据如表所示(已知:T1<T2)
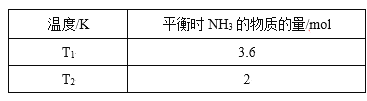
①则K1______K2,(填“>”、“<”或“=”)原因:_______。
②在T2下,经过10s达到化学平衡状态,则0~10s内N2的平均速率v(N2)为______,平衡时H2的转化率为______。若再同时增加各物质的量为1 mol,该反应的平衡V正_____V逆,(>或=或<)平衡常数将_____(填“增大”、“减小”或“不变”)
③下列能说明该反应已达到平衡状态的是___。
A.3v(H2)正=2v(NH3)逆 B.容器内气体压强不变
C.混合气体的平均相对分子质量不再改变的状态 D.△H保持不变
(2)已知下列化学键的键能写出工业上制氨的热化学方程式:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 430 | 936 | 390 |
热化学方程式:__________。
(3)下列是科研小组设计的一个氮氧化物原电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n(惰性电极)相连接,工作原理示意图如图:
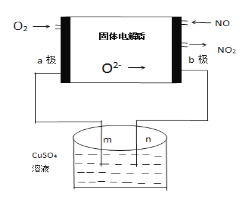
①a为___极,b极的电极反应式____________。
②在标准状况下,通入112mL的O2,可观察到烧杯中n处有_____生成,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的PH为______。