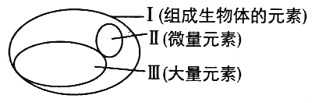
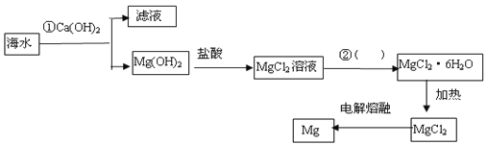
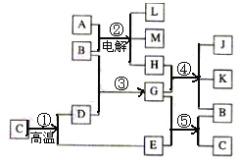
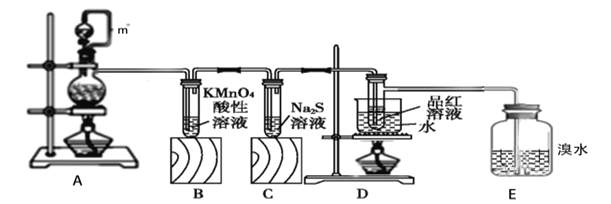
题目内容
【题目】某溶液中可能含有下列 6 种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为了确认溶液的组成,进行了如下实验:
①取 200mL 上述溶液,加入足量 BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀 4.30g。向沉淀中加入过量的盐酸,有2.33g沉淀不溶解。
②向①的滤液中加入足量NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体1.12L (已换算成标准状况,假定产生的气体全部逸出)。
③原溶液焰色反应呈黄色。
关于原溶液组成的结论,不正确的是
A.一定存在Cl-、SO42-、CO32-、NH4+,可能存在Na+、K+
B.至少存在五种离子,且c(Cl-)≥0.05mol/L
C.c(CO32-)=0.05mol/L
D.c(NH4+)>c(SO42-)
【答案】B
【解析】
由实验①可知,m(BaSO4)=2.33g,m(BaCO3)= 4.30g-2.33g=1.97g,
n(BaSO4)=![]() ,m(BaCO3)=
,m(BaCO3)=![]() ,
,
则n(SO42-)=0.01mol,n(CO32-)=0.01mol。
n(NH4+)= n(NH3)=![]()
因为溶液中正电荷为0.05mol,负电荷为0.04mol,依据电荷守恒,溶液中一定还含有阴离子,即Cl-。若不含有Na+、K+,则n(Cl-)=0.01mol;若Na+、K+含一种或两种,则n(Cl-)>0.01mol。
A. 由以上分析知,溶液中一定存在Cl-、SO42-、CO32-、NH4+,可能存在Na+、K+,A正确;
B. 至少存在四种离子而不是五种离子,且c(Cl-)≥0.05mol/L,B错误;
C. c(CO32-)=![]() =0.05mol/L,C正确;
=0.05mol/L,C正确;
D.因为n(NH4+)>n(SO42-),所以c(NH4+)>c(SO42-),D正确。
故选B。

【题目】X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
X | Y | Z | |
原子半径/nm | 0.154 | 0.130 | 0.071 |
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是
A. 原子最外层电子数:Z>X>Y
B. 三种元素可能为同周期元素
C. 原子序数:Y>X>Z
D. 离子半径:X>Y>Z