题目内容
【题目】有一含有NaCl、Na2CO3.10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应前后CO2和H2O的质量,来确定该混合物中各组分的质量分数.
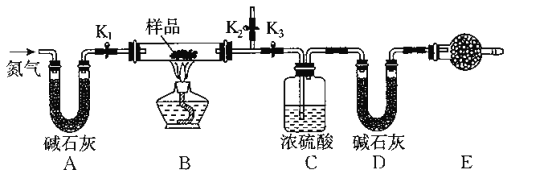
(1)实验步骤
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_______________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1 K2,关闭K3,缓慢鼓入氮气数分钟,其目的是_____________________。
④关闭活塞K1 K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓慢鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是__________________________。
②E处干燥管中盛放的药品是_________,其作用是_________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为wg,反应后C、D装置增加的质量分别为mg、ng,则混合物中Na2CO3.10H20的质量分数为________(用含w、m、n的代数式表示)。
【答案】检验装置的气密性 赶走装置中含有水蒸气和二氧化碳,减少误差 会使测定的二氧化碳和水的质量偏小,使碳酸氢钠和十水合碳酸钠在混合物中的质量分数偏小 碱石灰 吸收空气中的二氧化碳和水 偏大 ![]()
【解析】
(1)①组装好实验装置后首先应检查装置气密性;
③由于装置中存在CO2和水蒸气,缓慢鼓入氮气数分钟,其目的是赶走装置中含有水蒸气和二氧化碳,减少误差;
(2)①加热后有部分CO2和水蒸气会残留在装置中,必须鼓入空气使其排出完全被吸收,若不鼓入空气,则会使测定的二氧化碳和水的质量偏小,使碳酸氢钠和十水合碳酸钠在混合物中的质量分数偏小;
②装置E是防止空气中的CO2和水蒸气进入装置D,故干燥管中盛放的药品是碱石灰,如果没有该装置,会使测得的NaHCO3的质量分数偏大;
③由题目信息知反应放出的CO2的质量为ng,根据反应的化学方程式2NaHCO3![]() Na2CO3+H2O↑+CO2↑,可计算出该反应中产生的水的质量
Na2CO3+H2O↑+CO2↑,可计算出该反应中产生的水的质量![]() g,从而计算出Na2CO3·10H2O分解产生水的质量为(m-
g,从而计算出Na2CO3·10H2O分解产生水的质量为(m-![]() )g,再根据Na2CO3·10H2O
)g,再根据Na2CO3·10H2O ![]() Na2CO3+10H2O↑,计算出Na2CO3·10H2O的质量为(m-
Na2CO3+10H2O↑,计算出Na2CO3·10H2O的质量为(m-![]() )g×
)g×![]() =g,最后计算出混合物中Na2CO3·10H2O的质量分数为
=g,最后计算出混合物中Na2CO3·10H2O的质量分数为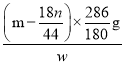 ×100%=
×100%=![]() 。
。

【题目】X、Y、Z均为短周期元素,其中两种为金属元素,一种为非金属元素,其原子半径分别为
X | Y | Z | |
原子半径/nm | 0.154 | 0.130 | 0.071 |
X、Y处于同一周期,三种元素形成的简单离子具有相同的电子层结构。下列说法正确的是
A. 原子最外层电子数:Z>X>Y
B. 三种元素可能为同周期元素
C. 原子序数:Y>X>Z
D. 离子半径:X>Y>Z
【题目】探究溶液酸碱性对![]() 溶液的配制和保存的影响。10mL
溶液的配制和保存的影响。10mL![]() 或10mL
或10mL![]() 溶液中。
溶液中。
I.![]() 溶液的配制
溶液的配制
将![]() 分别溶于10mL蒸馏水或10mL
分别溶于10mL蒸馏水或10mL
溶液编号 | 溶剂 | 溶液性状 | |
① | 蒸馏水 | 浅黄色澄清溶液: | 遇 |
② |
| 无色澄清溶液: | 遇 |
③ |
| 无色澄清溶液 | 遇 |
(1)用平衡移动原理解释①显酸性的主要原因是________________
(2)②、③变红发生反应的离子方程式是_______________________
(3)甲同学认为①中一定有+3价铁。他用激光笔照射“溶液”,观察到光路:又向含有KSCN的①中滴入试剂a,溶液变红,说明其推断正确,试剂a是____________
II ![]() 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
溶液编号 | 溶液性状 | |
① | 橙色浑浊 | 用 |
② | 无色溶液 | 滴加5滴 |
③ | 无色溶液 | 滴加5滴 |
(分析讨论)①②说明酸性减弱时,![]() 溶液更易变质;②③说明……
溶液更易变质;②③说明……
(查阅资料)在一定pH范围内,+2价铁的还原性随酸性减弱而增强,氧气的氧化性随酸性的增强而增强。
(进行实验)用右图所示装置完成实验(滴加试剂时溶液体积和溶液导电性变化可忽略)。向右池持续稳定通人氧气,待电流表示数稳定后:
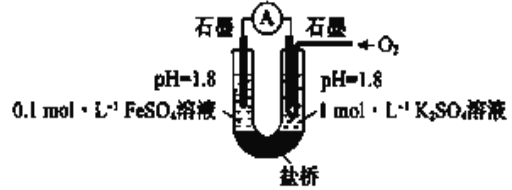
I 向左池滴加浓硫酸至![]() 接近
接近![]() ,电流没有明显变化
,电流没有明显变化
II 向右池滴加等量浓硫酸,电流明显增大。
(4)补全(分析讨论):②③说明_______________
(5)ii中右池的电极反应方程式是____________________
(6)依据实验推断:③比②中![]() 更易变质的原因是___________________
更易变质的原因是___________________
(7)按上述原理及装置重新进行实验证实①中![]() 更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
更易变质的原因。实验方案及预期现象是:向右池持续稳定通人氧气,待电流计示数稳定后,____________
(8)依据实验,配制并保存![]() 溶液的最佳法是_________________。
溶液的最佳法是_________________。
【题目】下列指定反应的化学用语表达正确的是( )
A | Mg(HCO3)2溶液与足量的NaOH溶液反应 | Mg2++2HCO |
B | 过量SO2通入到NaClO溶液中: | SO2+H2O+ClO-===HClO+ |
C | 向Al2(SO4)3溶液中加入过量的稀氨水 | Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O |
D | KClO碱性溶液与Fe(OH)3反应制取K2FeO4 | 3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O |
A. AB. BC. CD. D