题目内容
10.草酸(乙二酸)存在于自然界的植物中.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题: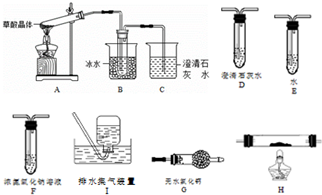
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物.装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有CO2.装置B的主要作用是冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验.
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验.
①乙组同学的实验装置中,依次连接的合理顺序为A、B、F、D、G、H、D、I.装置H反应管中盛有的物质是CuO.
②能证明草酸晶体分解产物中有CO的现象是H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊.
分析 (1)草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊;草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,B装置温度较低,有冷凝作用,防止干扰实验;
(2)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO的还原性将CO氧化,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO;H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊.
解答 解:(1)草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有二氧化碳生成;
草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置温度较低,有冷凝作用,防止干扰二氧化碳的检验,
故答案为:有气泡冒出,澄清石灰水变浑浊;CO2;冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验;
(2)①要检验生成CO,在甲组实验后,用浓氢氧化钠除去二氧化碳,用澄清石灰水检验二氧化碳,用碱石灰干燥CO,利用CO和CuO发生还原反应生成CO2,再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO避免环境污染,所以其连接顺序是A、B、F、D、G、H、D、I;
H装置中盛放的物质应该具有氧化性,且和CO反应有明显现象发生,CuO能被CO还原且反应过程中黑色固体变为红色,现象明显,所以H中盛放的物质是CuO,
故答案为:F、D、G、H、D、I;CuO;
②CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,且CO将黑色的CuO还原为红色的Cu,只要H中黑色固体转化为红色且其后的D装置溶液变浑浊就说明含有CO,
故答案为:H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊.
点评 本题考查性质实验方案设计,为高频考点,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度较大.

 习题精选系列答案
习题精选系列答案| A. | 常温常压下,44g CO2所含的原子数目约为3NA | |
| B. | 2.3g钠在空气中氧化成Na2O转移电子数为0.2NA | |
| C. | 在标准状况时,22.4L CCl4所含的原子数为5NA | |
| D. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA |
| A. | 澄清的石灰水与盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 钠与水的反应 Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铜片插入硝酸银溶液 Cu+Ag+=Cu2++Ag | |
| D. | 大理石溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| A. | 125m/9V mol/L | B. | 125m/18 V mol/L | ||
| C. | 125 m/36V mol/L | D. | 125 m/54V mol/L |
| A. | KHCO3+HNO3;K2CO3+HNO3 | B. | Ba(OH)2+HCl;KOH+H2SO4 | ||
| C. | CuCl2+NaOH;CuSO4+NH3•H2O | D. | NaHCO3+H2SO4;Ba(HCO3)2+H2SO4 |
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 强电解质溶液不一定比弱电解质溶液的导电性强 | |
| C. | 盐酸、氢氧化钠、硫酸钡和氧化铝一定是强电解质 | |
| D. | 强、弱电解质的导电性由溶液中溶质的浓度决定 |
| A. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液 | |
| B. | 0.1mol/L的盐酸和0.05mol/L的氢氧化钡溶液 | |
| C. | pH=3的醋酸和pH=11的氢氧化钠溶液 | |
| D. | pH=3的盐酸和pH=l1的氨水 |
| A. | 观察是否发生了化合反应 | |
| B. | 观察是否有氧气参加反应 | |
| C. | 观察是否有单质参加反应 | |
| D. | 观察反应前后是否有元素的化合价发生变化 |
 H++HS-HS-
H++HS-HS-