题目内容
某恒温密闭容器中,可逆反应A(s)  B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
 B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
BC
若B是气体,平衡常数K=c(B)·c(C),若c(C) 不变,则c(B)也不变,可得K不变、若B是非气体,平衡常数K=c(C),此时C(g)的浓度不变,因此A错误,C正确;根据平衡时的v(正)=v(逆)可知B正确(注意:不是浓度消耗相等);由于反应是可逆反应,因此D项达到平衡时放出热量小于Q,错误。
本题考查化学平衡、可逆反应的含义。
本题考查化学平衡、可逆反应的含义。

练习册系列答案
相关题目
 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ① CH3OH(g)。
CH3OH(g)。
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
 2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是
2C(g)在不同温度和压强时A的转化率如表所示。由此可知,下列图像正确的是

 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
 H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:
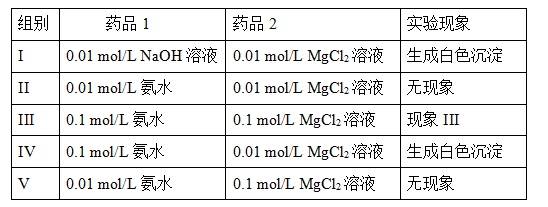
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。 2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
2NH3(g) 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
 cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
 CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
 Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。