题目内容
I.800℃时,向容积为2L的恒容密闭容器中充入一定量的CO和H2O维持恒温,发生反应CO(g)+H2O(g)
 H2(g)+CO2(g),反应过???中测定的部分数据见下表:
H2(g)+CO2(g),反应过???中测定的部分数据见下表:| 反应时间/min | 0 | 2 | 4 | 6 |
| n(CO)/mol | 1.20 | 0.90 | | 0.80 |
| n(H2O)/ mol | 0.60 | | 0.20 | |
②800℃时,化学平衡常数K的值为______________;
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率______(填“增大”或“减小”或“不变”)。
④在恒温恒压密闭容器中通入CO和H2O各1 mol发生该反应,当反应达到平衡后,维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图。
II.实验室中利用复分解反应制取Mg(OH)2。实验数据和现象如下表所示(溶液体积均取用1mL):
①现象III是 ;
②如果向0.028 mol/L的MgCl2溶液中加入等体积的NaOH溶液,请计算NaOH溶液的浓度至少达到 mol/L时,溶液中开始出现白色沉淀(Ksp(Mg(OH)2)= 5.6×10-12)。
③MgCl2溶液和氨水混合后存在下列化学平衡:
Mg2+(aq) + 2NH3·H2O(aq)
 2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。
2NH4+(aq) + Mg(OH)2(s)该反应化学平衡常数的表达式为K= ,列出该反应平衡常数K与Kb(NH3·H2O)、Ksp(Mg(OH)2)的关系式 。Ⅰ①0.075 mol·L-1·min-1 ②1 ③增大
④
Ⅱ①生成白色沉淀 ②4×10-5 mol·L-1③K=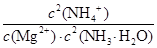 ;K=
;K=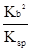
④

Ⅱ①生成白色沉淀 ②4×10-5 mol·L-1③K=
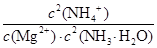 ;K=
;K=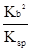
Ⅰ.①根据表中数据可知,反应在2 min时CO的物质的量减少了1.20mol-0.90mol=0.30mol。根据方程式可知,水蒸气的物质的量也减少0.30mol,其浓度是0.30mol÷2L=0.15mol/L,所以2min内的平均速率为v(H2O)=0.15mol/2min=0.075 mol·L-1·min-1。
②2min时水蒸气的物质的量是0.30mol,3min时是0.20mol,减少0.10mol,则3min时CO的物质的量是0.80mol。由于4min时CO的物质的量也是0.8mol,这说明反应在3min时达到平衡状态,则
CO(g)+H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始物质的浓度(mol/L) 0.60 0.30 0 0
变化物质的量浓度(mol/L) 0.20 0.20 0.20 0.20
平衡物质的量浓度(mol/L) 0.40 0.10 0.20 0.20
所以平衡常数K=0.20×0.20/0.40×0.10=1.0
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,增大水蒸气的浓度,平衡向正反应方向进行,因此CO的转化率增大。
④维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,则容器的容积必然增大。由于反应前后体积不变,所以平衡是等效的。但正反应速率增大,逆反应速率减小,而平衡状态不变,因此正确的图像是
 。
。
Ⅱ①根据表中数据可知,实验Ⅲ和Ⅳ相比,氨水的浓度相同,实验Ⅲ中氯化镁的浓度高于实验Ⅳ中氯化镁的浓度。由于实验Ⅳ中有白色沉淀氢氧化镁生成,所以所以Ⅲ中一定生成白色沉淀氢氧化镁。
②设NaOH溶液的浓度至少达到x,则混合物后溶液中是OH-浓度0.5x。由于混合后溶液中镁离子浓度是0.014mol/L,所以要生成氢氧化镁沉淀,则(0.5x)2·0.014≥5.6×10-12,解得x≥4×10-5mol/L。
③化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该可逆反应的平衡常数K=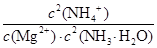 。K=
。K= =
=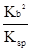
②2min时水蒸气的物质的量是0.30mol,3min时是0.20mol,减少0.10mol,则3min时CO的物质的量是0.80mol。由于4min时CO的物质的量也是0.8mol,这说明反应在3min时达到平衡状态,则
CO(g)+H2O(g)
 H2(g) + CO2(g)
H2(g) + CO2(g)起始物质的浓度(mol/L) 0.60 0.30 0 0
变化物质的量浓度(mol/L) 0.20 0.20 0.20 0.20
平衡物质的量浓度(mol/L) 0.40 0.10 0.20 0.20
所以平衡常数K=0.20×0.20/0.40×0.10=1.0
③保持其他条件不变,向平衡体系中再通入0.20 mol H2O,增大水蒸气的浓度,平衡向正反应方向进行,因此CO的转化率增大。
④维持温度与压强不变,t1时再通入各1 mol的CO和H2O的混合气体,则容器的容积必然增大。由于反应前后体积不变,所以平衡是等效的。但正反应速率增大,逆反应速率减小,而平衡状态不变,因此正确的图像是
 。
。Ⅱ①根据表中数据可知,实验Ⅲ和Ⅳ相比,氨水的浓度相同,实验Ⅲ中氯化镁的浓度高于实验Ⅳ中氯化镁的浓度。由于实验Ⅳ中有白色沉淀氢氧化镁生成,所以所以Ⅲ中一定生成白色沉淀氢氧化镁。
②设NaOH溶液的浓度至少达到x,则混合物后溶液中是OH-浓度0.5x。由于混合后溶液中镁离子浓度是0.014mol/L,所以要生成氢氧化镁沉淀,则(0.5x)2·0.014≥5.6×10-12,解得x≥4×10-5mol/L。
③化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,该可逆反应的平衡常数K=
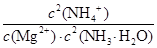 。K=
。K= =
=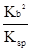

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
 CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。 )+c(HCO
)+c(HCO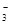 )+c(H2CO3)
)+c(H2CO3) c(CO
c(CO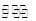 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态
C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态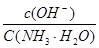 增大
增大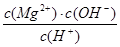 不变
不变 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( ) SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2 B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。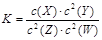 ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是 2Z(g) + 2W(g)
2Z(g) + 2W(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示: