题目内容
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
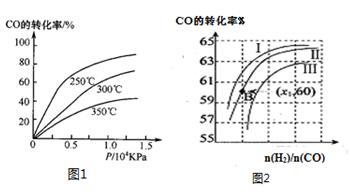
已知: C(s)+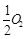 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
E. 混合气体的密度增大
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K= 。
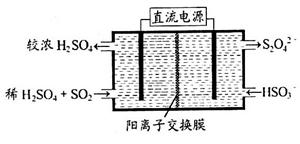
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O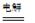 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇 kg(计算结果保留2位小数)
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+
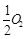 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K= 。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O
 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇 kg(计算结果保留2位小数)
(16分)
(1) SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ·mol-1(3分)
(2)①<(1分) K1>K2>K3(2分) 3 (2分)
②A C (2分) ③4.5 L2·mol-2 (不带单位不扣分)(2分)
(3)①CH3CHO-2e-+H2O═CH3COOH+2H+ (2分) ②0.19(2分)
(1) SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ·mol-1(3分)
(2)①<(1分) K1>K2>K3(2分) 3 (2分)
②A C (2分) ③4.5 L2·mol-2 (不带单位不扣分)(2分)
(3)①CH3CHO-2e-+H2O═CH3COOH+2H+ (2分) ②0.19(2分)
试题分析:(1)根据盖斯定律得,目标方程式=②×2-①×2-③,ΔH=(-393.5kJ·mol-1)×2-(-126.4kJ/mol)×2-(-296.8kJ·mol-1)=-237.4kJ·mol-1,所以所求热化学方程式为SO2(g)+2CO(g)=S(s)+2CO2(g) ΔH=-237.4kJ·mol-1;
(2)①由图1可知,温度升高CO的转化率降低,说明升高温度,平衡逆向移动,正向是放热反应,ΔH<0;n(H2)/n(CO)一定时,CO的转化率Ⅰ>Ⅱ>Ⅲ,转化率高的平衡常数大,所以K1、K2、K3的大小关系为K1>K2>K3测得B(X1,60)点氢气的转化率为40%,CO的转化率是60%,设B点时CO、H2的物质的量分别是m、n,可得60%m=40%n/2,所以n/m=3,即x1=3;
②A、增大反应物浓度,正反应速率先增大后减小,说明平衡正向移动,正确;B、增大生成物浓度,逆反应速率先增大后减小,说明平衡逆向移动,错误;C、降低温度,K值增大,说明生成物浓度增大,反应物浓度减小,平衡正向移动,正确;D、减小压强,平衡逆向移动,反应物的体积百分含量增大,错误;E、恒容条件时混合气体的密度增大,说明容器中气体质量增加,可能是反应物也可能是生成物,平衡移动方向不确定,错误,答案选AC;
③设平衡时CO的浓度是x,则氢气的浓度是2x-1,生成甲醇的浓度是1-x,根据题意得:x/(2x-1)=2:1,x=2/3mol/L,所以K=(1-x)/x·(2x-1)2=4.5 L2·mol-2
(3)①阳极发生氧化反应,乙醛被氧化为乙酸,氢氧根离子被氧化为氧气,则阴极发生还原反应,乙醛被还原为乙醇,同时氢离子被还原为氢气,所以阳极电极反应式除生成氧气外,还有CH3CHO-2e-+H2O═CH3COOH+2H+
②阴极反应是CH3CHO+2e-+2H+=CH3CH2OH,所以注入1m3乙醛的含量为300mg/L的废水,阴极区乙醛的去除率可达60%,生成乙醇的质量是1000L×300mg/L×60%×10-3g/mg÷44g/mol×46g/mol=188.2g=0.19kg。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
 CH4 (g)+2H2O(g)
CH4 (g)+2H2O(g)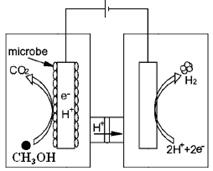
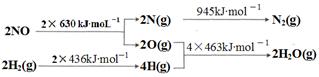
 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
 Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H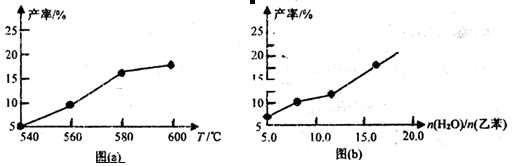

 CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。 )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3) c(CO
c(CO 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )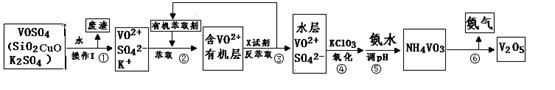
 VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层) 
 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。 B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是