题目内容
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。已知:CO2(g)+3H2(g) 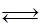 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
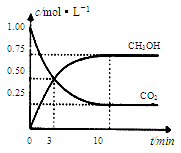
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
| A.0~3 min内,v(CO2)正 =v (CH3OH)正 |
| B.其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动 |
| C.在T1℃时,若起始时向容器中充入2molCO2和6mol H2 , 测得平衡时容器内压强为P2, 则 P2<2P1 |
| D.T2℃时,上述反应平衡常数为4.2,则T2>T1 |
B
试题分析:A、根据化学反应速率之比等于化学计量数之比,0~3 min内,v(CO2)正 =v (CH3OH)正,正确;B、其他条件不变,若向平衡后的体系中充入1mol氦气,虽然体系压强增大,但与反应相关的物质的浓度不变,平衡不移动,错误;C、在T1℃时,若起始时向容器中充入2molCO2和6mol H2 , 相当于增大压强,平衡正向移动,容器内气体的物质的量减小,测得平衡时容器内压强为P2, 则 P2<2P1,正确;D、由题给图像可知,T1℃时,各物质的平衡浓度分别为:c(CH3OH)=c(H2O)=0.75mol/L,c(CO2)=0.25mol/L,c(H2)=0.75mol/L,则平衡常数K=16/3>4.2,该反应为放热反应,升高温度平衡常数减小,所以T2>T1,正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 Ph—CH=CH2(g)+H2(g) △H
Ph—CH=CH2(g)+H2(g) △H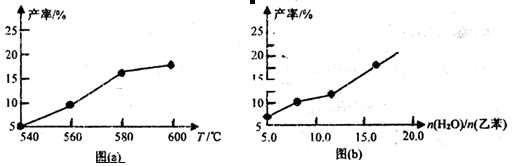

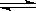 2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。 I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是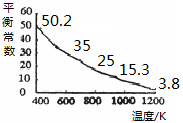
 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( )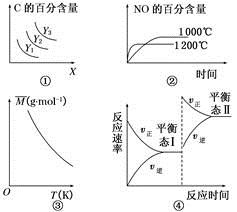
 3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是 2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是
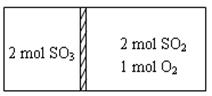
2SO3并达到平衡.在反应过程中,若A容器保持体积不变,B容器保持压强不变,当 A 中的 SO2 的转化率为 25% 时,则 B 容器中 SO2 的转化率应是 2SO3(g) ?H=?196kJ·moL?1。现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的
2SO3(g) ?H=?196kJ·moL?1。现有密闭容器,中间隔板不能传导热量但可自由滑动,按如图所示投料,一段时间达到平衡时,下列说法正确的