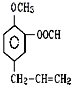
题目内容
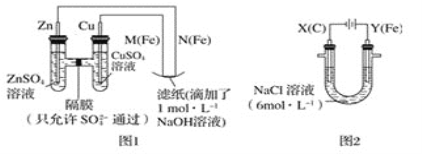
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究。
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是___(填字母序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应式为___。
(3)实验过程中,SO42-___(填“从左向右”,“从右向左”或“不”)移动;滤纸上能观察到的现象有:___。
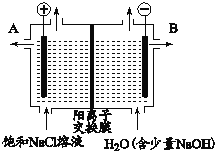
Ⅱ.用图2所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料得知,高铁酸根离子(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH___(填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应之一为Fe﹣6e-+8OH-=FeO42-+4H2O,若在X极收集到784mL气体,在Y极收集到112mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少___g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为___。
【答案】A 2H++2e-=H2↑(或2H2O+2e-=H2↑+2OH-) 从右向左 滤纸上有红褐色斑点 增大 0.56 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】
Ⅰ.图1中左边为原电池,由于Zn比Cu活泼,则Zn为负极,Cu为正极,M为阳极,N为阴极;
(1)在保证电极反应不变的情况下,仍然是锌作负极,则正极材料必须是不如锌活泼的金属或导电的非金属,铝是比锌活泼的金属,所以不能代替铜,故选 ![]() 。
。
(2)![]() 电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:
电极连接原电池负极,所以是电解池阴极,阴极上氢离子得电子发生还原反应,电极反应式为:![]() (或
(或![]() )。
)。
(3)原电池放电时,阴离子向负极移动,所以硫酸根从右向左移动,电解池中,阴极上氢离子得电子生成氢气,阳极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁,所以滤纸上有红褐色斑点产生。
Ⅱ.图2中Y(Fe)为阳极,X(C)为阴极;
(4)电解过程中,阴极上氢离子放电生成氢气,则阴极附近氢氧根离子浓度大于氢离子溶液,溶液呈碱性,溶液的 ![]() 增大。
增大。
(5)![]() 电极上析出的是氢气,
电极上析出的是氢气,![]() 电极上析出的是氯气,且
电极上析出的是氯气,且 ![]() 电极失电子进入溶液,设铁质量减少为
电极失电子进入溶液,设铁质量减少为 ![]() ,根据转移电子数相等得
,根据转移电子数相等得 ![]() ,解得
,解得![]() 。
。
(6)正极上高铁酸根离子得电子发生还原反应,电极反应式为 ![]() 。
。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案