题目内容
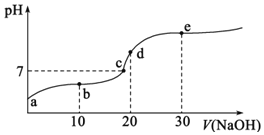
【题目】常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol·L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是
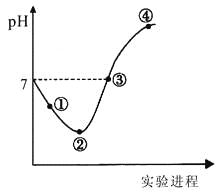
A.曲线起点处水的电离程度最大,可用pH试纸测定溶液pH
B.②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO-
C.氯气~氯水体系中:c(H+)=c(Cl2) +c(HClO)+c(ClO-)
D.③点所示溶液中:c(Na+) = c(Cl-)+c(ClO-)
【答案】D
【解析】
A.曲线起点处水的电离程度不是最大,氢氧化钠溶液与氯水完全反应时有NaClO生成,NaClO水解会促进水的电离,比纯水的电离程度大,A错误;
B. ②点之前所发生反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,B错误;
C. 关系式不成立,C错误;
D. ③点根据电荷守恒有:c(H+)+c(Na+) = c(Cl-)+c(ClO-)+ c(OH-),溶液显中性,则c(OH-)= c(H+),故有c(Na+) = c(Cl-)+c(ClO-),D正确;
答案选D。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)该学习小组用pH试纸对上述0.5000 mol·L-1醋酸溶液进行了pH测定,请用文字描述pH试纸的使用方法______。
(3)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
则该醋酸溶液的浓度为________________。
(4)实验(2)中,滴定过程中pH变化曲线如图所示(室温条件下)。

①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为____________。
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9。则混合溶液中:水的电离度是纯水的_____倍;
(5)在滴定过程中,下列操作会造成结果偏高的是________。
A.滴定终点时,滴定管尖嘴处有半滴悬而未落
B.读取NaOH溶液体积时,开始仰视读数,滴定结束后俯视读数
C.滴定过程中向锥形瓶中加水
D.滴定管水洗后未用标准液润洗