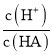题目内容
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
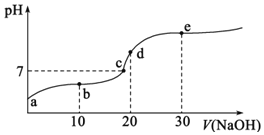
的NaOH溶液滴定![]() 相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是
相同浓度的HX溶液,滴定曲线如图所示。下列说法正确的是![]()
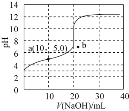
A.达到滴定终点时,溶液的![]()
B.根据图象可估算出![]() 的值约为
的值约为![]()
C.a点所得溶液中:![]()
D.若用相同浓度的氨水替代NaOH溶液,滴定终点移向b点
【答案】B
【解析】
A.起始时HX溶液的pH为3,HX是弱酸,达到滴定终点时恰好生成弱酸强碱盐NaX,水解显碱性,所以达到滴定终点时,溶液的![]() ,故A错误;
,故A错误;
B.起始时HX溶液的pH为3,则溶液中![]() ,
,![]() ,则HX的电离常数
,则HX的电离常数 ,故B正确;
,故B正确;
C.a点为加入NaOH溶液体积为10mL,恰好反应生成等量的NaX和HX,溶液呈酸性,说明![]() 水解程度小于HX电离程度,则溶液中
水解程度小于HX电离程度,则溶液中![]() ,故C错误;
,故C错误;
D.滴定终点是指酸碱恰好反应,与酸碱的强弱及滴定终点溶液的酸碱性无关,所以用相同浓度的氨水替代NaOH溶液,滴定终点时消耗氨水仍为20mL,滴定终点不移动,故D错误;
故选:B。

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
【题目】由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是( )
酸 | 电离常数 |
碳酸 | K1=4×10-7 K2=5.6×10-11 |
亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
A.SO2+H2O+2CO32-=2HCO3-+SO32-
B.SO2+H2O+CO32-=H2O+CO2+SO32-
C.2SO2+2H2O+CO32-=H2O+CO2+2HSO3-
D.SO2+H2O+CO32-=HCO3-+HSO3-