题目内容
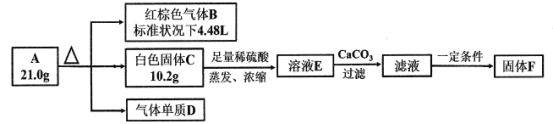
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
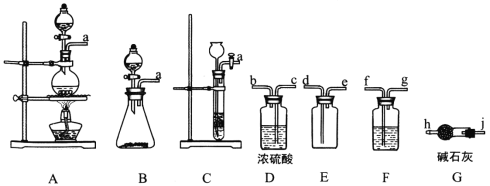
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的化学方程式为_______________________________________________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 A→_______→_______→________→_______ (按气流方向,用装置的大写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
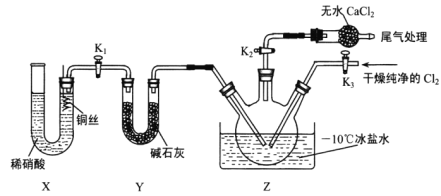
①实验室也可用 B装置制备NO,与B装置相比 X装置的优点为____________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是______,然后打开K1,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是____,亚硝酰氯(ClNO)的质量分数为_____。(已知:Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
【答案】A;MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O); F D E G 排除装置内空气的干扰 可以随开随用,随关随停 排干净三颈瓶中的空气 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化
Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O); F D E G 排除装置内空气的干扰 可以随开随用,随关随停 排干净三颈瓶中的空气 滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化 ![]() %
%
【解析】
(1)由二氧化锰与浓盐酸加热(或高锰酸钾与浓盐酸)制备氯气,根据反应条件选择可得;
(2)制得的氯气混有HCl和水蒸气,一次用饱和食盐水、浓硫酸除去,氯气密度比空气大,选择导气管长进短出的收集方法,最后用碱石灰吸收多余的氯气,防止污染空气,据此分析可得;
(3)X制备NO气体,Y干燥NO气体,干燥的NO与氯气在Z中反应,
①X装置的优点是可以排除装置内空气的干扰;可以随开随用,随关随停;
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是排干净三颈瓶中的空气;
(4)已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,利用Ag2CrO4为砖红色沉淀来指示反应达到终点,氯元素守恒:ClNO~HCl~AgNO3,结合化学方程式定量关系计算亚硝酞氯(ClNO)的质量分数。
(1)制取氯气可以用二氧化锰与浓盐酸加热或高锰酸钾与浓盐酸反应制得,选择A,发生的离子反应为:MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O,若选择B,发生的离子反应为:2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O,故答案为:A;MnO2+4H++2Cl
Mn2++Cl2↑+2H2O,若选择B,发生的离子反应为:2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O,故答案为:A;MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O);
Mn2++Cl2↑+2H2O; (或B;2MnO4+16H++10Cl=2Mn2++5Cl2↑+8H2O);
(2)制得的氯气混有HCl和水蒸气,一次用饱和食盐水、浓硫酸除去,为保证除杂彻底,导气管均长进短出,氯气密度比空气大,选择导气管长进短出的收集方法,最后用碱石灰吸收多余的氯气,防止污染空气,故导气管连接顺序为a→f→g→c→b→d→e→j→h,装置F→D→E→G,故答案为:F;D;E;G;
(3)①用B装置制备NO,与之相比X装置可以排除装置内空气的干扰;可以随开随用,随关随停,故答案为:排除装置内空气的干扰;可以随开随用,随关随停;
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是排干净三颈瓶中的空气,故答案为:排干净三颈瓶中的空气;
(4)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用cmolL1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化,说明反应达到终点,
根据氯元素守恒:ClNOHClAgNO3,
11
ncmol/L×20.00×103L×![]()
n=cmol/L×20.00×103L×![]() =c×20.00×103×10mol=0.2c mol,
=c×20.00×103×10mol=0.2c mol,
亚硝酞氯(ClNO)的质量数=![]() ×100%=
×100%=![]() %,故答案为:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化;
%,故答案为:滴入最后一滴标准溶液,溶液中生成砖红色沉淀且半分钟内无变化;![]() %。
%。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
N2 | O2 | Ar | CO2 |
-196℃ | -183℃ | -186℃ | -78℃ |
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是______.
(2)雷雨时空气中的N2转化为NO,生成物NO是______色的气体,______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为__________________.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气;
①制取氨气的化学方程式为__________________;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为______g;
(4)已知:4NH3+6NO![]() 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能;
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能; ![]()
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同);
①NH3与稀硫酸溶液反应的离子方程式为__________________;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是____________。