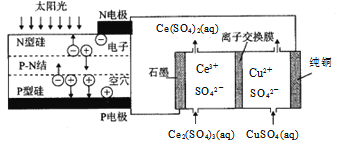
题目内容
【题目】下列关于晶体的说法不正确的是( )
A.在离子晶体中,正、负离子半径比(![]() )越大,晶体的配位数越大
)越大,晶体的配位数越大
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4,阴、阳离子配位数不相等主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2的高主要是因为MgO中的离子键比MgCl2中的离子键强
D.金属晶体和离子晶体都能导电
【答案】D
【解析】
A.离子键无饱和性和方向性,但成键时离子半径决定了阴、阳离子参与生成的数目是有限的,阴、阳离子半径比值越大,配位数就越大,A项正确;
B.在CaF2晶体中,Ca2+和F-的电荷比(绝对值)是2:l,Ca2+和F-的个数比是l:2,Ca2+的配位数为8,F-的配位数为4,B项正确;
C.离子晶体熔点的高低决定于晶体中阴阳离子之间的静电引力,即离子键越强,晶体熔沸点越高,MgO的熔点比MgCl2的高主要是因为MgO中的离子键比MgCl2中的离子键强,C项正确;
D.金属晶体能导电,离子晶体不导电,但熔化或溶于水后能导电,D项错误;
答案选D。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入 | 该溶液中一定含有 |
A.AB.BC.CD.D