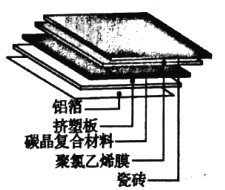
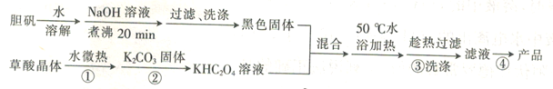
题目内容
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO![]() =HCO
=HCO![]()
B.草酸(H2C2O4,弱酸)溶液中加入酸性KMnO4溶液: 2MnO![]() +5C2O
+5C2O![]() +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液: Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
【答案】C
【解析】
A. 往稀盐酸中逐滴加入Na2CO3溶液,开始时盐酸过量,氢离子浓度较大,反应生成水和二氧化碳,反应的离子方程式为:2H++CO![]() =H2O+CO2↑,选项A错误;
=H2O+CO2↑,选项A错误;
B. 草酸为弱酸,必须写化学式,故草酸(H2C2O4)溶液中加入酸性KMnO4溶液,反应的离子方程式为: 2MnO![]() +5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,选项B错误;
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,选项B错误;
C. 往少量澄清石灰水中加入Ca(HCO3)2溶液,反应生成碳酸钙和水,反应的离子方程式为:Ca2++OH-+HCO![]() =CaCO3↓+H2O,选项C正确;
=CaCO3↓+H2O,选项C正确;
D. 用HI溶液溶解Fe2O3固体,反应生成碘化亚铁、碘和水,反应的离子方程式为:Fe2O3+6H++2I-=2Fe2++3H2O+I2,选项D错误;
答案选C。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目