题目内容
10.将下列溶液加水稀释至100mL,含Cl-浓度最大的是( )| A. | 10 mL 0.1 mol•L-1的氯化铝溶液 | B. | 20 mL 0.1 mol•L-1的氯化钙溶液 | ||
| C. | 30 mL 0.2 mol•L-1的氯化钾溶液 | D. | 40 mL 0.25 mol•L-1的氯化钠溶液 |
分析 电解质溶液中氯离子浓度=电解质浓度×化学式中氯离子数目,再根据n=cV计算氯离子物质的量,氯离子物质的量越大,加水稀释至100mL后溶液中Cl-浓度越大.
解答 解:A.10 mL 0.1 mol•L-1的氯化铝溶液中n(Cl-)=0.01L×0.1mol/L×3=0.003mol;
B.20 mL 0.1 mol•L-1的氯化钙溶液中n(Cl-)=0.02L×0.1mol/L×2=0.004mol;
C.30 mL 0.2 mol•L-1的氯化钾溶液中n(Cl-)=0.03L×0.2mol/L×1=0.006mol;
D.40 mL 0.25 mol•L-1的氯化钠溶液中n(Cl-)=0.04L×0.25mol/L×1=0.01mol;
氯离子物质的量越大,加水稀释至100mL后溶液中Cl-浓度越大,
故选:D.
点评 本题考查溶液物质的量浓度计算,比较基础,注意电解质溶液中离子浓度与溶液体积无关.

练习册系列答案
相关题目
20.常温常压下,乙烷、乙炔和丙烯组成的混合烃64mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了112mL,原混合烃中乙炔的体积分数为( )
| A. | 12.5% | B. | 25% | C. | 50% | D. | 75% |
18.在标准状况下,容积为1L的密闭容器中刚好可以盛放a个N2分子和b个H2分子组成的混合气体,则阿伏加德罗常数的近似值可以表示为( )
| A. | a+b | B. | 22.4 (a+b)×6.02×1023 | ||
| C. | $\frac{22.4(a+b)}{6.02}$×1023 | D. | 22.4 (a+b) |
5.在10-9~10-7 m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化.如纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸.下列说法不正确的是( )
| A. | 纳米铜是一种新型化合物 | |
| B. | 纳米铜颗粒比普通铜具有更强的化学活性 | |
| C. | 纳米铜粒子大小介于1~100 nm | |
| D. | 利用丁达尔现象可区别纳米铜和普通铜 |
15.常温下,给蒸馏水中滴入少量氢氧化钠后,下列说法中错误的是( )
| A. | [H+][OH-]乘积不变 | B. | pH增大了 | ||
| C. | [H+]降低了 | D. | 水电离出的[H+]增加了 |
19. 有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( )
有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( )
 有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( )
有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( )| A. | 催化剂作用下与H2反应 | B. | 与NaOH水溶液反应 | ||
| C. | 发生银镜反应 | D. | 与乙酸发生酯化反应 |
11. 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是放暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加 B.重新配料 C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(6)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50% C.61% D.70%
 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图:可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是放暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是D(填正确答案标号).
A.立即补加 B.重新配料 C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口倒出”).
(4)分离提纯过程中加入无水氯化钙的目的是干燥.
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有C(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(6)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50% C.61% D.70%
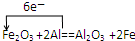 .
.