题目内容
2.Fe2O3+2Al═Al2O3+2Fe所属基本反应类型是置换.根据此反应可得出金属的还原性为Al>Fe(填>,=或<)用单线桥法表示该反应的电子转移情况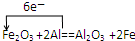 .
.
分析 Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe中,Fe元素的化合价降低,Al元素的化合价升高,结合氧化还原反应基本概念以及置换反应的定义来解答即可.
解答 解:此反应为一种单质与一种化合物生成另外一种单质与另一种化合物的反应,属于置换反应类型,铝置换出铁,则可得出金属的还原性为Al>Fe,Fe2O3+3Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Fe中Fe元素化合价降低,被还原,Fe2O3为氧化剂,Al元素化合价升高,被氧化,为还原剂,则Fe得到2×3e-,Al失去2×3e-,
电子转移数目和方向可表示为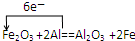 ,
,
故答案为:置换;>;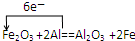 .
.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用单线桥法表示电子转移的方向和数目,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
10.将下列溶液加水稀释至100mL,含Cl-浓度最大的是( )
| A. | 10 mL 0.1 mol•L-1的氯化铝溶液 | B. | 20 mL 0.1 mol•L-1的氯化钙溶液 | ||
| C. | 30 mL 0.2 mol•L-1的氯化钾溶液 | D. | 40 mL 0.25 mol•L-1的氯化钠溶液 |
17.已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则反应④2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则反应④2C(s)+2H2(g)+O2(g)═CH3COOH(l)的焓变为( )
| A. | 488.3 kJ/mol | B. | -224.15 kJ/mol | C. | -488.3 kJ/mol | D. | 244.15 kJ/mol |
 、
、 .
.