题目内容
8.铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:
3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,有3mol FeS2参加反应,转移32mol电子.
(2)写出SO2通入氯化铁溶液中反应的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
分析 (1)反应中Fe元素、S元素化合价升高,O元素化合价由0价降低为-2价,计算参加反应氧气物质的量,根据元素化合价变化计算转移电子;
(2)Fe3+将SO2氧化生成硫酸,自身被还原为Fe2+.
解答 解:(1)反应中O元素化合价降低,Fe元素由+2价升高为+3价、S元素化合价由-2价升高为+4价,
有3mol FeS2参加反应,由方程式可知参加反应的氧气为8mol,反应中Fe元素、S元素化合价升高,O元素化合价由0价降低为-2价,则转移电子为8mol×2×2[0-(-2)]=32mol,
故答案为:32;
(2)Fe3+将SO2氧化生成硫酸,自身被还原为Fe2+,反应离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查氧化还原反应有关知识,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
20.对下面①和②两个结构简式的说法中,正确的是( )
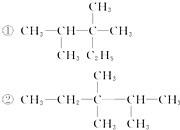

| A. | ①是2,3-二甲基-2-乙基丁烷 ②是3,3,4-三甲基戊烷 | |
| B. | ①②互为同系物 | |
| C. | ①②是同一种物质 | |
| D. | ①②互为同分异构体 |
19.把V L含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-(1mol铝离子消耗4molNaOH生成1mol AlO2-);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4.则原混合溶液中Mg2+的浓度为( )
| A. | $\frac{8b-3a}{2v}$mol•L-1 | B. | $\frac{8b-3a}{4v}$mol•L-1 | C. | $\frac{8b-3a}{v}$mol•L-1 | D. | $\frac{a-2b}{2v}$mol•L-1 |
16.100mL 0.5mol/L (NH4)2SO4溶液c (SO42-)为( )
| A. | 2 mol/L | B. | 1.5mol/L | C. | 1.0 mol/L | D. | 0.5 mol/L |
3.某小组为研究电化学原理,设计如图装置.下列叙述正确的是( )


| A. | a和b不连接时,铁片、铜片上均无反应发生 | |
| B. | a和b用导线连接时,溶液中Cu2+向铁电极移动 | |
| C. | a和b分别连接直流电源正、负极,铜电极质量减少 | |
| D. | a和b分别连接直流电源正、负极,溶液中Cu2+向铜电极移动 |
20.下列事实与胶体性质无关的是( )
| A. | “尿毒症”患者做血液透析治疗 | |
| B. | 在河流入海处易形成沙洲 | |
| C. | 在豆浆里加入盐卤做豆腐 | |
| D. | 三氯化铁溶液中滴入氢氧化钠液出现红褐色沉淀 |
18.下列各组物质中,所含分子数相同的是( )
| A. | 5g H2和5g N2 | B. | 224mlN2(标准状况)和0.1molCO | ||
| C. | 16gO2和0.5molSO2 | D. | 22.4LH2O(标准状况)和1molO2 |