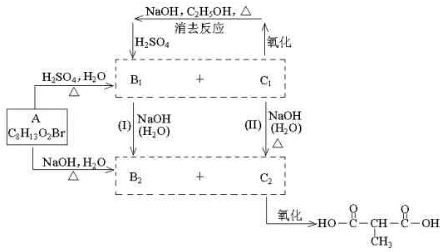
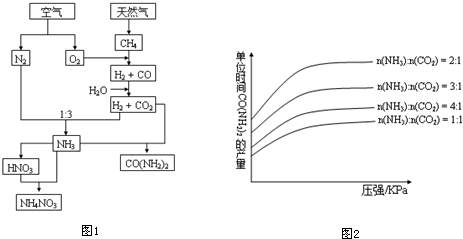
题目内容
19.把V L含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-(1mol铝离子消耗4molNaOH生成1mol AlO2-);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4.则原混合溶液中Mg2+的浓度为( )| A. | $\frac{8b-3a}{2v}$mol•L-1 | B. | $\frac{8b-3a}{4v}$mol•L-1 | C. | $\frac{8b-3a}{v}$mol•L-1 | D. | $\frac{a-2b}{2v}$mol•L-1 |
分析 混合溶液分成两等份,每份溶液浓度相同,设每份溶液中含有Mg2+、Al3+的物质的量分别为x、y;一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-,则:①2x+4y=amol;
另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(SO42-)=n(BaSO4)=n(BaCl2),再利用电荷守恒可知每份中2n(Mg2+)+3n(Al3+)=2(SO42-),即:②2x+3y=2bmol,据此计算每份中n(Mg2+),根据c=$\frac{n}{V}$计算镁离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度相同,设每份溶液中含有Mg2+、Al3+的物质的量分别为x、y,
一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2-,则:①2x+4y=amol,
另一份加入含bmol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4,根据钡离子与硫酸根守恒可知该份中n(SO42-)=BaSO4=n(BaCl2)=bmol;
由电荷守恒可知每份中:2n(Mg2+)+3n(Al3+)=2(SO42-),即:②2x+3y=2bmol,
联立①②解得:x=$\frac{8b-3a}{2}$mol、y=(a-2b)mol,
每份溶液的体积为0.5Vl,则每份混合溶液中Mg2+的浓度为:c(Mg2+)=$\frac{\frac{8b-3a}{2}mol}{\frac{1}{2}VL}$=$\frac{8b-3a}{V}$mol/L,
溶液具有均一性,则原混合液中镁离子的浓度为$\frac{8b-3a}{V}$mol/L,
故选C.
点评 本题考查了混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握电荷守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

| A. | 泡沫灭火器的灭火原理涉及的离子反应方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑ | |
| B. | 将Na2S溶液加入FeCl3溶液中的离子反应方程式为:3S2-+2Fe3++6H2O=2Fe(OH)3↓+3H2S↑ | |
| C. | 已知H2的燃烧热为283 kJ•mol-1,则表示H2燃烧热的热化学方程式为:2 H2 (g)+O2(g)=2 H2O(l)△H=-566 kJ•mol-1 | |
| D. | 向1L 1 mol/L NaOH溶液中加入一定量浓H2SO4溶液至恰好完全反应时,共放出65 kJ的热量.则表示该反应的中和热的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-65kJ•mol-1 |
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
(1)反应在t1min内的平均速率为v(H2)=$\frac{0.20}{{t}_{1}}$mol•L-1•min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时,n(CO2)=0.40mol.
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大(填“增大”或“减小”或“不变”),H2O的体积分数增大(填“增大”或“减小”或“不变”).
(4)温度升至800℃,上述反应平衡常数为0.64,则正反应为放热反应(填“放热”或“吸热”).
(5)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则平衡向正移动(正、逆、不).
| A. | 酚酞为无色的溶液:I-、CH3COO-、NO3-、Na+ | |
| B. | 甲基橙呈黄色的溶液中:Na+、CO32-、NO3-、NH4+ | |
| C. | 含大量Al3+的溶液中:K+、Na+、S2-、NO3- | |
| D. | pH>7的溶液中:CO32-、Cl-、F-、K+ |
| A. | 油脂没有固定的熔点和沸点,油脂是混合物 | |
| B. | 天然油脂大多是由混甘油酯分子构成的混合物 | |
| C. | 油脂的主要成分是高级脂肪酸的甘油酯,是酯的一种 | |
| D. | 油脂不能发生水解反应 |