题目内容
8.某同学弄清氨的喷泉实验原理后有了一个创新的设计:如果改换烧瓶内的气体和胶头滴管与烧杯中的液体,也能做成喷泉实验.下列各组中的气体和液体不符合该学生设计的一组是( )| A. | HCl和水 | B. | CO2和NaOH溶液 | C. | NO和水 | D. | Cl2和NaOH溶液 |
分析 要形成喷泉,必须满足则烧瓶内的气体应溶于溶液或与溶液发生反应,烧瓶内的气体体积减小,导致烧瓶内的压强小于大气压,
A、氯化氢极易溶于水;
B、二氧化碳与氢氧化钠溶液反应;
C、NO不溶于水,难与水反应;
D、氯气能够与氢氧化钠溶液反应.
解答 解:A.氯化氢极易溶于水而导致烧瓶内的压强小于大气压,可形成喷泉,故A不选;
B.二氧化碳和NaOH反应而导致烧瓶内的压强小于大气压,可形成喷泉,故B不选;
C.NO难溶于水,也难与水反应,不能形成喷泉,故C选;
D.氯气和NaOH反应生成氯化钠和次氯酸钠,导致烧瓶内的压强小于大气压,可形成喷泉,故D不选;
故选C.
点评 本题考查喷泉实验形成条件的探究,侧重于物质的性质的考查,注意把握喷泉实验形成原理,题目难度不大.

练习册系列答案
相关题目
18.下列说法不正确的是( )
| A. | 淀粉中加碘水后变蓝 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 蛋白质水解能得到氨基酸 | |
| D. | 淀粉和纤维素互为同分异构体 |
19.有一澄清透明的溶液可能含有H+、AlO2-、CO32-、Cl-、NO3-、Ag+、Fe3+、Fe2+、Al3+、NH4+十种离子中的几种,向溶液中逐滴加入一定量1mol•L-1 NaOH溶液,开始产生沉淀并逐渐增多,随后又逐渐减少,整个过程始终无气体放出.则下列判断正确的是( )
| A. | 可能含有Ag+、Al3+、NH4+ | B. | 一定不含Cl-,可能含有NO3- | ||
| C. | 一定不含NH4+、AlO2-、CO32- | D. | 可能含有Fe3+,一定不含Fe2+ |
16.在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最大的是( )
| A. | v(A2)=0.8mol•L-1•s-1 | B. | v(A2)=60mol•L-1•min-1 | ||
| C. | v(AB3)=1.0mol•L-1•s-1 | D. | v(B2)=1.2mol•L-1•s-1 |
3.下列各表述与示意图一致的是( )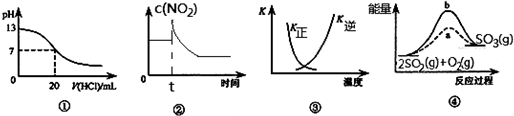

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 | |
| C. | 图③中曲线表示反应N2 (g)+3 H2(g)═2NH3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| D. | 图④中a、b曲线分别表示反应2SO2(g)+O2(g)═2SO3(g)△H<0使用(a)和未使用(b)催化剂时,应过程中的能量变化 |
13.若表为周期表的一部分,其中M的单质与水反应时,水作还原剂,下列说法正确的是( )
| Y | X | M | ||
| Z | W |
| A. | 最低价离子半径Y、X、M依次减小 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 工业上通过电解Z的氯化物来冶炼Z单质 | |
| D. | Y、W、X三种元素最低价氢化物的沸点依次升高 |
17.从海水中提取镁,主要步骤如图所示:下列说法不正确的是( )
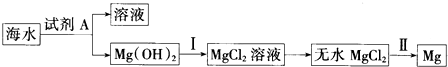

| A. | 试剂A为石灰乳,价格低廉,可来自贝壳 | |
| B. | 操作Ⅰ中加入的试剂为盐酸 | |
| C. | 以上提取镁的过程中没有涉及氧化还原反应 | |
| D. | 操作Ⅱ的条件为电解 |
18.Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )
| A. | FeCl2可通过化合反应一步制得 | |
| B. | 不能用稀盐酸区别二氧化锰、氧化铜、还原铁粉三种黑色粉末 | |
| C. | 采用将MgSO4溶液直接蒸干的方法不能制备MgSO4固体 | |
| D. | 可通过电解熔融MgCl2来制取Mg,故也可通过电解熔融的AlCl3来制取Al |
 溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下: