题目内容
【题目】大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H3=-393.5kJ·mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(E)的热化学方程式__________________。
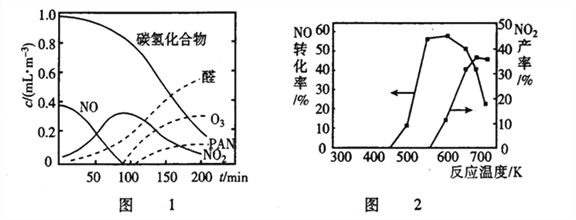
②醛类、O3、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图1所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议___________________。
(2)利用NH3催化还原氮氧化物(SCR技术)是目前应用广泛的烟气脱硝技术。
①SCR技术的主要化学反应之一是2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
②SCR技术的另一主要反应为4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
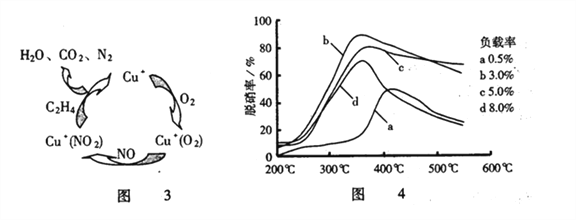
①写出该脱硝原理总反应的化学方程式______________________。
②为达到最佳脱硝效果,应选择的条件是______________________。
【答案】2NO(g)+2CO(g) =N2(g)+2CO2(g) △H= -746.5kJ·mol-1 减少机动车有害尾气的排放 ![]() < 4NH3+7O2
< 4NH3+7O2 ![]() 4NO2+6H2O 6NO+3O2+ 2C2H4
4NO2+6H2O 6NO+3O2+ 2C2H4![]() 3N2+4CO2+4H2O 约为350℃、负载率3.0 %
3N2+4CO2+4H2O 约为350℃、负载率3.0 %
【解析】
(1)①已知:(1)![]() ═
═![]()
(2)![]() ═
═![]()
(3)![]() ═
═![]()
根据盖斯定律,(3)![]() 可得:
可得:![]() ,故
,故![]() ,
,
反应热化学方程式为:![]() ,
,
因此,本题正确答案是:![]() .
.
②由图可知,随着时间的加长,烃类、氮的氧化物逐渐转化为醛、PAN、臭氧,会形成光化学烟雾,减少光化学烟雾的发生,可减少氮的氧化物的排放,如减少汽车尾气的排放。
(2)①SCR技术的主要化学反应之一是2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=
2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K= ![]() ,因为该反应的平衡常数K随温度T的升高而减小,所以△H. <0 。本题答案:. < 。
,因为该反应的平衡常数K随温度T的升高而减小,所以△H. <0 。本题答案:. < 。
②反应![]()
![]() 是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化,反应方程式:4NH3+7O2
是放热反应,升温平衡逆向移动,温度升高时还会发生氨气的催化氧化,反应方程式:4NH3+7O2 ![]() 4NO2+6H2O因此,本题正确答案是:温度升高,发生了副反应:
4NO2+6H2O因此,本题正确答案是:温度升高,发生了副反应:![]() ═
═![]() ;温度升高,
;温度升高,
(3)根据图1可以知道,在催化剂的作用下,![]() 与NO、
与NO、![]() 反应最终生成
反应最终生成![]() 、
、![]() 、
、![]() ,反应总方程式为6NO+3O2+ 2C2H4
,反应总方程式为6NO+3O2+ 2C2H4![]() 3N2+4CO2+4H2O:,
3N2+4CO2+4H2O:,
因此,本题正确答案是: 6NO+3O2+ 2C2H4![]() 3N2+4CO2+4H2O;
3N2+4CO2+4H2O;
(2)由图可以知道,b曲线的最高点处,脱硝率高,负载率低,温度温度适宜,适宜适合条件为![]() 、负载率3%,因此,本题正确答案是:
、负载率3%,因此,本题正确答案是:![]() 、负载率
、负载率![]() .
.

 阅读快车系列答案
阅读快车系列答案