题目内容
13.下列关于浓HNO3和浓H2SO4的叙述中正确的是( )| A. | 由于浓HNO3和浓H2SO4氧化性均较强,常温下都不可用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都减小 |
分析 A.浓HNO3和浓H2SO4氧化性均较强,常温下能够使铝钝化;
B.浓硫酸具有吸水性,浓硝酸具有挥发性;
C.铜与浓硫酸常温下不反应;
D.浓硫酸具有吸水性,浓硝酸具有挥发性.
解答 解:A.浓HNO3和浓H2SO4氧化性均较强,常温下能够使铝钝化,形成致密氧化膜,阻止反应进行,所以能够用铝制容器贮存盛放,故A错误;
B.浓硫酸具有吸水性,露置空气中质量增加;浓硝酸具有挥发性,露置与空气中质量减少,故B错误;
C.铜与浓硝酸常温下反应,与浓硫酸在常温下不反应,故C错误;
D.浓硝酸易挥发使溶质减少,浓硫酸具有吸水性使溶剂增多,则露置在空气中,容器内酸液的浓度都降低,故D正确;
故选:D.
点评 本题考查浓硝酸和浓硫酸的性质,为高频考点,把握浓酸的强氧化性、浓硫酸的三大特性为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->Cl->Br-
④稳定性:HCl>H2S>PH3.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->Cl->Br-
④稳定性:HCl>H2S>PH3.
| A. | 都正确 | B. | ①②③ | C. | ②③④ | D. | ①②④ |
11.下列装置、试剂选用或操作正确的是( )
| A. | 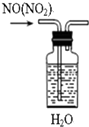 除去NO中的NO2 | B. | 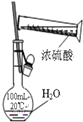 稀释浓硫酸 | ||
| C. |  实验室制取NH3 | D. | 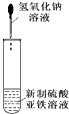 制备氢氧化亚铁并观察其颜色 |
1.某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验.
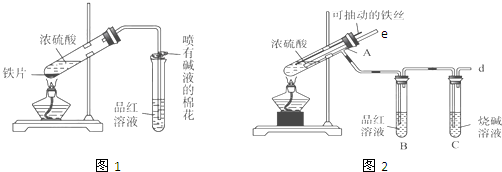
(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:

(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色有明显变化,则说明Ⅱ成立. (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立. |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性高锰酸钾溶液 | 如果滴加酸性高锰酸钾溶液后溶液的紫红色褪色,则说明溶液中含有亚铁离子,说明Ⅲ成立;如果滴加酸性高锰酸钾溶液后溶液紫红色不褪,则说明溶液中没有亚铁离子,说明Ⅰ成立. |
5.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
①由上述实验可知:溶液中Fe元素的存在形式有Fe2+、Fe3+.
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
提示:KSCN中S元素的化合价为-2价
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
③查阅资料得知:Cl-对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是分别取2mL0.1mol/LFeCl3溶液和2mL 0.05mol/L Fe2(SO4)3溶液,分别滴入KSCN溶液,溶液均变为红色;再分别加入等浓度等体积的H2O2溶液,FeCl3溶液褪色快(或取0.05mol/L Fe2(SO4)3溶液,滴入KSCN溶液,溶液变红色,将红色溶液分为2份,1份加入NaCl固体,另一份不变,向这两份溶液中均加入等浓度等体积的H2O2溶液,加入NaCl的溶液红色迅速褪色).
(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2, 无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
③查阅资料得知:Cl-对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是分别取2mL0.1mol/LFeCl3溶液和2mL 0.05mol/L Fe2(SO4)3溶液,分别滴入KSCN溶液,溶液均变为红色;再分别加入等浓度等体积的H2O2溶液,FeCl3溶液褪色快(或取0.05mol/L Fe2(SO4)3溶液,滴入KSCN溶液,溶液变红色,将红色溶液分为2份,1份加入NaCl固体,另一份不变,向这两份溶液中均加入等浓度等体积的H2O2溶液,加入NaCl的溶液红色迅速褪色).
3.在一定温度下将Cl2通入NaOH溶液中,得到ClO-、ClO3-等离子,其物质的量n(mol)随反应时间t(min)的变化如图所示.下列有关说法正确的是( )
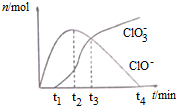

| A. | t1时,溶液中Na+、NH4+、CO32-、S2-可以大量共存 | |
| B. | t2时,溶液中含氯微粒浓度大小:c(ClO-)>c(Cl-)>c(ClO3-) | |
| C. | t3时,离子方程式为:4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O | |
| D. | t4时,因c(ClO-)接近于0,所以c(ClO3-)=c(Cl-) |
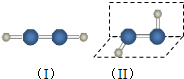 过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空: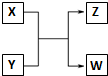 已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:
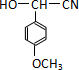
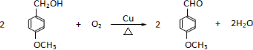
已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题: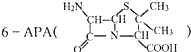 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图: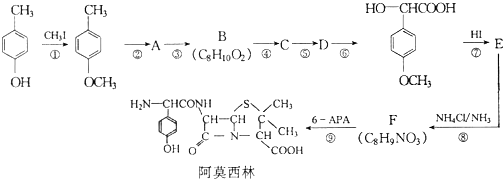
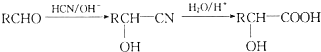
 .
. .
.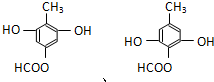 .
.