题目内容
5.某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.(1)铝和氧化铁反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(2)固体成分的初步确定.
| 实验序号 | 操作及现象 |
| ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
③生成O2的化学方程式是2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4.
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
| 实验序号 | 操作、现象 |
| ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; 另一份滴加BaCl2溶液,产生白色沉淀,加入盐酸,沉淀不溶解 |
| ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2, 无明显变化.再加入H2O2溶液,红色很快褪去 |
①实验ⅲ中白色沉淀的化学式是BaSO4.
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是溶液中SCN-离子被H2O2氧化,溶液红色褪去.
③查阅资料得知:Cl-对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是分别取2mL0.1mol/LFeCl3溶液和2mL 0.05mol/L Fe2(SO4)3溶液,分别滴入KSCN溶液,溶液均变为红色;再分别加入等浓度等体积的H2O2溶液,FeCl3溶液褪色快(或取0.05mol/L Fe2(SO4)3溶液,滴入KSCN溶液,溶液变红色,将红色溶液分为2份,1份加入NaCl固体,另一份不变,向这两份溶液中均加入等浓度等体积的H2O2溶液,加入NaCl的溶液红色迅速褪色).
分析 (1)Al在高温下与氧化铁反应生成铁和氧化铝,据此写出反应的化学方程式;
(2)①向溶液中加入少量KSCN溶液,溶液呈浅红色,说明溶液中含有Fe3+;溶液变为深红色,说明溶液加入过量双氧水后溶液中铁离子浓度增大,则原溶液中含有Fe2+;
②利用金属铝能够与氢氧化钠溶液反应为铁不反应检验,Al与氢氧化钠溶液反应生成偏铝酸钠和氢气;
③双氧水在催化剂存在条件下能够分解生成水和氧气;
(3)实验ⅱ中溶液红色褪去的原因必然是Fe3+或SCN-被消耗所致,实验ⅲ首先验证实验ⅱ剩余的溶液中存在铁离子,然后证明溶液中存在硫酸根离子,从而证明SCN-被氧化;实验ⅳ证明氧化SCN-的是双氧水,而不是氧气,据此进行解答①②.
③证明Cl-对溶液红色褪去的反应有催化作用,可以将氯化铁溶液改成硫酸铁,然后重复实验,根据溶液褪色情况判断.
解答 解:(1)Al与氧化铁在高温下发生铝热反应生成氧化铝和铁,反应的化学方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)①向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,说明溶液中含有Fe3+,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,说明溶液加入双氧水后溶液中铁离子浓度增大,则原溶液中含有Fe2+,
故答案为:Fe2+、Fe3+;
②金属铝能够与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,改写成离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,而铁不与氢氧化钠溶液反应,据此可以检验是否含有Al,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③双氧水在铁离子作催化剂条件下分解生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑;
(3)实验ⅱ中溶液红色褪去的原因必然是Fe3+或SCN-被消耗所致,实验ⅲ首先验证实验ⅱ剩余的溶液中存在铁离子,然后证明溶液中存在硫酸根离子,从而证明SCN-被氧化;实验ⅳ证明氧化SCN-的是双氧水,而不是氧气,
①加入氯化钡溶液后生成不溶于盐酸的白色沉淀为BaSO4,
故答案为:BaSO4;
②溶液中存在平衡:Fe3++3SCN-?Fe(SCN)3,加入双氧水后SCN-被氧化,SCN-的浓度减小,平衡向着逆向移动,所以溶液红色褪去,
故答案为:溶液中SCN-离子被H2O2氧化,溶液红色褪去;
③将实验ⅳ中2mL 0.1mol/L FeCl3溶液改为2mL 0.05mol/L Fe2(SO4)3溶液,重复该实验,现象为:加入双氧水溶液后,红色过一段时间褪去(或缓慢褪去),具体操作方法及现象为:分别取2mL 0.1mol/L FeCl3溶液和2mL 0.05mol/L Fe2(SO4)3溶液,分别滴入KSCN溶液,溶液均变为红色;再分别加入等浓度等体积的H2O2溶液,FeCl3溶液褪色快(或取0.05mol/L Fe2(SO4)3溶液,滴入KSCN溶液,溶液变红色,将红色溶液分为2份,1份加入NaCl固体,另一份不变,向这两份溶液中均加入等浓度等体积的H2O2溶液,加入NaCl的溶液红色迅速褪色),
故答案为:分别取2mL0.1mol/LFeCl3溶液和2mL 0.05mol/L Fe2(SO4)3溶液,分别滴入KSCN溶液,溶液均变为红色;再分别加入等浓度等体积的H2O2溶液,FeCl3溶液褪色快(或取0.05mol/L Fe2(SO4)3溶液,滴入KSCN溶液,溶液变红色,将红色溶液分为2份,1份加入NaCl固体,另一份不变,向这两份溶液中均加入等浓度等体积的H2O2溶液,加入NaCl的溶液红色迅速褪色).
点评 本题考查了探究探究物质组成及性质实验方案的设计,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握常见物质的性质及性质实验方案设计与评价原则.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案| A. | X的离子半径>Y的离子半径 | |
| B. | Z的氢化物稳定性>W的氢化物稳定性 | |
| C. | 化合物X2W2和Y2W3中都不含配位键 | |
| D. | 1 mol ZW2晶体所含Z-W键的数目为4NA |
| A. | 金属性:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2CO3<HSO4<HClO4 | D. | 熔点:Na>K>Rb |
| A. | 由于浓HNO3和浓H2SO4氧化性均较强,常温下都不可用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都减轻 | |
| C. | 常温下都能与铜较快反应 | |
| D. | 露置在空气中,容器内酸液的浓度都减小 |
| A. | 煤的干馏和煤的液化均是物理变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
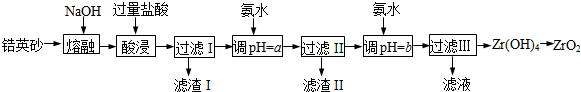
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+.
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如表.
| 金属离子 | Fe3+ | Al3+ | ZrO2+ |
| 开始沉淀时pH | 1.9 | 3.3 | 6.2 |
| 沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是5.2~6.2;继续加氨水至pH=b时,所发生反应的离子方程式为ZrO2++2NH3•H2O+H2O=Zr(OH)4↓+2NH4+.
(3)向过滤Ⅲ所得滤液中加入CaCO3粉末并加热,得到两种气体.该反应的离子方程式为2NH4++CaCO3=Ca2++2NH3↑+CO2↑+H2O.
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净.
| A. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 | |
| B. | 大豆富含蛋白质,故豆浆煮沸后蛋白质变成了氨基酸 | |
| C. | 石油的分馏、煤的气化、海水提溴的过程都包含化学变化 | |
| D. | 地淘油经处理后可作为汽车燃油,故地沟油的成分是液态烃 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 随核电荷数递增,同主族元素的简单阴离子还原性递增减 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |